크론병 환자의 소장조영술 판독
Interpretation of Enterography in Patients with Crohn’s Disease
Article information
Abstract
CT 소장조영술과 MR 소장조영술은 현재 크론병 환자의 소장을 평가하기 위한 영상의학적 검사 중 가장 발전된 검사이다. 이 종설은 소장조영술을 보다 정확하고 임상적 맥락에 부합하도록 판독하는데 필요한 최신의 실용적 지식을 양질의 대표적 영상과 함께 설명하며, 이를 통하여 환자의 진료 향상에 기여할 수 있도록 한다. 특히 MR 소장조영술의 해석을 중점적으로 설명한다. 소장조영술의 판독은 크론병의 진단 및 다른 유사 질환과의 감별, 장 염증의 활동도 및 범위의 평가, 합병증의 평가, 질환의 전체적 중증도 평가, 관해의 진단, 동반 질환의 발견을 포함한다. 영상소견을 좀 더 효과적으로 정확하게 임상의들에게 전달하기 위해서는 판독자가 환자들의 임상적 상황에 대해서 잘 이해를 하고 좀 더 표준화된 판독을 하려는 노력이 필요하다.
Trans Abstract
Computed tomography enterography and magnetic resonance enterography are presently state-of-the-art radiological tests to examine the small bowel in patients with Crohn’s disease. This review provides up-todate practical knowledge, including high-quality exemplary figures, to make the interpretation of enterography examinations more accurate and clinically relevant for improved care of patients with Crohn’s disease, emphasizing the interpretation of magnetic resonance enterography. The interpretative tasks include the diagnosis of the disease (through differential diagnosis from other mimicking conditions); specific assessment of the inflammatory activity, disease extent, and complications; assessment of the overall disease severity; diagnosis of remission; and identification of comorbidities. A good understanding of the clinical context of the patient and efforts to achieve more standardized interpretation is critical for more effective and more precise delivery of information.
서 론
크론병은 수십 년 전만 하더라도 우리나라에 매우 드문 병이었으나 발병이 지속해서 증가하여 이제는 과거보다 매우 높은 발병률을 보인다 [1]. 크론병의 치료 목표도 과거에는 환자의 증상 완화에 초점이 맞추어져 있었다면 현재는 면역조절제 또는 종양괴사인자 (tumor necrosis factor) 억제제를 포함한 다양한 생물학적 제제를 이용하여 염증을 조절하고 점막 치유를 유도 및 유지함으로써 장관 손상의 진행과 장애를 예방하는 것으로 변화되었다 [2, 3]. 따라서, 크론병의 초기 상태와 치료 후 질병 상태의 변화를 객관적으로 확인할 수 있는 영상 검사의 이용과 중요성이 더욱 강조되고 있다. 우리나라의 인구기반 역학 연구에 따르면 크론병 진단 시점을 기준으로 대장에만 병변이 있는 경우는 9.3%에 불과하고 90.7%의 환자에서는 대장과 회장 모두에 (65.8%) 또는 회장에만 (24.9%) 병변이 있었다 [1]. 이러한 이유로, 크론병을 검사할 때 당연히 회장을 포함한 소장의 검사가 중요한데, 말단 회장을 제외하고 소장의 대부분은 통상의 내시경으로 검사하기 어렵고 크론병 환자에서는 장 내강이 좁아져 캡슐내시경이 통과하지 못하는 경우가 종종 발생하기 때문에 캡슐내시경을 이용한 소장 검사도 어려운 경우가 많다. 따라서, CT나 MRI를 이용한 소장조영술이 크론병 환자의 검사에 있어 내시 경과 함께 중추적인 역할을 담당하고 있다 [4, 5]. 또한, CT나 MRI를 이용한 소장조영술은 내시경과는 달리 장의 전 층 및 장의 외부도 확인할 수 있다는 장점이 있다.
MR 소장조영술은 CT 소장조영술에 비해 늦게 등장하였고 우리나라의 경우 아직은 CT 소장조영술에 비해 상대적으로 제한적으로 활용되고 있는 것으로 보이나 크론병 환자의 주된 검사법으로 빠르게 자리를 잡아가고 있다. CT 소장조영술의 약점 중 하나는 방사선 조사인데 방사선 조사량이 과거보다 감소하였으나 크론병 환자들은 일반적으로 젊어서 CT 소장조영술 검사를 반복적으로 시행할 경우 방사선 노출로 인한 위해의 가능성을 완전히 배제하기 어렵다. 따라서, 크론병 환자에서 MR 소장조영술의 유용성이 더 주목받으며 크론병의 발병이 높은 서양에서는 우리나라보다 MR 소장조영술이 더 활발히 이용되고 있는 것으로 보인다. 이 논문은, 이러한 현재 상황들을 고려하여 MR 소장조영술을 중심으로 크론병 환자의 소장조영술 판독을 위한 실용적인 핵심 사항들을 대표적 영상 소견들과 함께 설명한다. 모든 설명은 크론병의 진단과 치료에 대한 현재의 최신 지식들을 반영한다. 이 논문은 소장 및 연관 부위의 소견 분석을 중점적으로 다루며, 크론병의 중요한 합병증의 하나인 항문 누공은 내용이 광범위하여 이 논문의 범위를 넘어 생략하였다.
크론병의 진단
크론병의 진단을 위해서는 먼저 크론병의 소장조영술 소견을 잘 알아야 한다. 크론병에 의한 장 염증의 소장조영술 소견은 많은 연구를 통해 이미 잘 알려져 있다 [6, 7]. 이 중 대표적 소견들이 Table 1에 정리되어 있으며 Fig. 1은 크론병에 의한 장 염증의 다양한 전형적 MR 소장조영술 소견들을 보여주고 있다. 이러한 소견들을 기억하는 것과 더불어 크론병에 의한 궤양 및 염증 병변들의 다양한 실제 모양과 이들이 소장조영술에서 어떻게 보이게 되는지를 하나하나 비교해 보는 것이 (Fig. 2) 소장조영술 소견을 더욱 정확히 이해하고 판독하는 데 큰 도움이 된다. 크론병의 장 병변은 초기에는 아프타성 병변이 산재하여 있는 형태로 나타나고 병변 중 일부가 점차 크기와 깊이가 증가하여 표재성 궤양을 거쳐 커다란 심부 궤양으로 진행하게 되며 나중에는 염증이 장의 전 층을 침범하게 된다. 이러한 병변들과 병변들 주변 장벽의 염증성 변화가 소장조영술에 장벽의 이상소견으로 보이게 된다. 아프타성 병변은 작아서 일반적으로 소장조영술에 이상소견이 잘 보이지 않거나 보이더라도 경미한 장벽의 비후나 조영증강 증가로 보이게 된다(Fig. 2). 반면, 최근에는 CT와 MRI의 성능이 좋아져서, 표재성 궤양과 심부 궤양의 경우에는 궤양 자체를 소장조영술에서 명확하게 볼 수 있는 경우도 많다 (Fig. 2). 궤양이 크고 깊다고 해서 소장조영술에 반드시 잘 보이는 것은 아니며 단면 영상 평편에 대한 궤양의 방향, 장의 팽창 정도, 그리고 주변 장벽의 상태에 따라 큰 궤양이 잘 보이지 않는 경우도 있고 반면 작은 궤양이 잘 보이는 경우도 있다 [8].

Characteristic MR enterography findings of bowel inflammation in Crohn’s disease.
Increased signal on T2 FS (i.e., edema), thickening, hyperenhancement, and restricted diffusion are noted in the wall of multiple ileal segments (arrows). The mural abnormalities are circumferential in some locations and involve the bowel's mesenteric side preferentially in some other locations. The mesentery adjacent to the mural abnormalities shows an increased signal on T2 FS, indicating perienteric edema (arrowheads in the left). Engorged vasa recta (arrowheads in the middle) are noted. Ulcer craters are not apparently demonstrated on these images. CE T1 = contrast-enhanced T1-weighted sequence; DWI = diffusion-weighted imaging; T2 FS = T2-weighted half-Fourier sequence with fat suppression
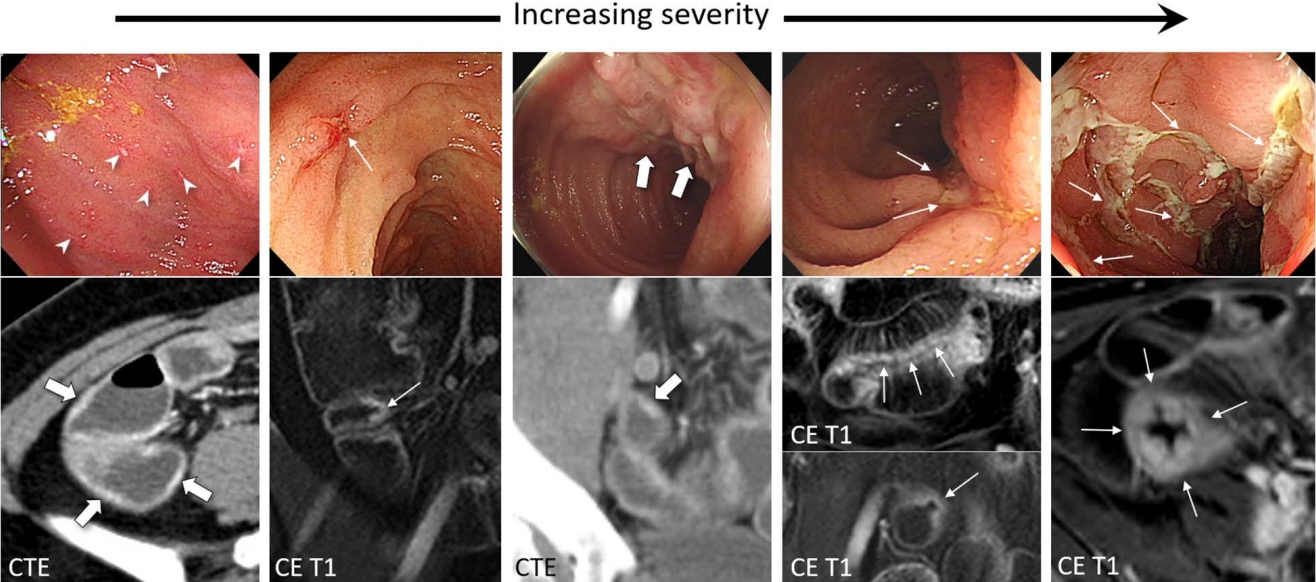
Endoscopy-enterography correlation of ileal inflammation in Crohn’s disease.
Various severities of inflammatory and ulcerative lesions with left-to-right increasing severities ranging from multiple tiny scattered aphthoid lesions (the leftmost) to multiple large deep longitudinal ulcers (the rightmost) are shown (arrows and arrowheads). Ulcer craters are directly seen on enterography for some of the lesions, including a small superficial ulcer (arrows in the second from the left), a deep longitudinal ulcer in the mesenteric border (arrows in the second from the right), and multiple deep longitudinal ulcers (arrows in the rightmost). The figure is in part from Park et al. (8) with permission. CE T1 = contrast-enhanced T1-weighted sequence; CTE = CT enterography
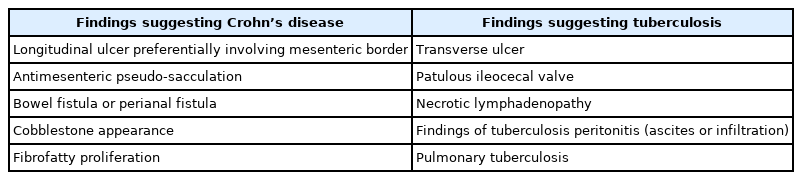
이러한 염증 병변들이 장간막 쪽을 따라 위치하는 것이 크론병에 특이적인 소견으로 알려져 있다 (Fig. 3) [6, 7]. 특히, 장간막 쪽에 장의 종축 방향을 따라 선형으로 배열된 종주 궤양이 크론병의 특징적 소견으로 알려져 있다 (Fig. 2). 하지만, 병변들이 항상 이런 분포를 보이는 것은 아니며 염증이 심하면 궤양을 동반한 광범위한 염증이 장 내강 전체에 걸쳐 분포하게 된다 (Figs. 1 and 2). 장간막 쪽을 따라 장의 종축 방향으로 배열된 염증 병변에 의하여 반흔이 형성되면 장의 장간막 면의 수축으로 인해 가성주머니모양(pseudo-sacculation)의 장 형태를 만들게 되며 이 소견도 크론병에 특이적인 소견이다 (Fig. 3B). 크론병은 특징적으로 염증 부위들이 염증이 없는 부위를 사이에 두고 비연속적으로 나타나는 건너뛰기 병변 (skipped lesion)의 소견을 보인다. 심한 염증이 있으면 크고 깊은 궤양들 사이에 남아있는 점막이 심한 부종성 변화로 인해 마치 조약돌을 깔아 놓은 듯한 양상 (cobblestone appearance)으로 보일 수 있다. 염증 병변들이 장간막 쪽을 따라 위치하는 소견이나 뒤에서 설명할 특징적인 누공을 동반하는 소견은 크론병에 특이적인 소견이지만, 크론병에서 보이는 다른 전형적 소견들은 다른 여러 염증성 장 질환들과 중복이 된다. 특히 장결핵은 크론병과 매우 유사한 영상 소견을 보일 수 있어 감별이 어렵다 (Fig. 4). 크론병과 장결핵을 구별하는 데 도움을 줄 수 있는 영상소견의 차이점을 Table 2에 요약해 놓았다 [9, 10]. 하지만, 이러한 구별 점이 없는 경우가 많다는 점에 항상 유의하여야 한다.
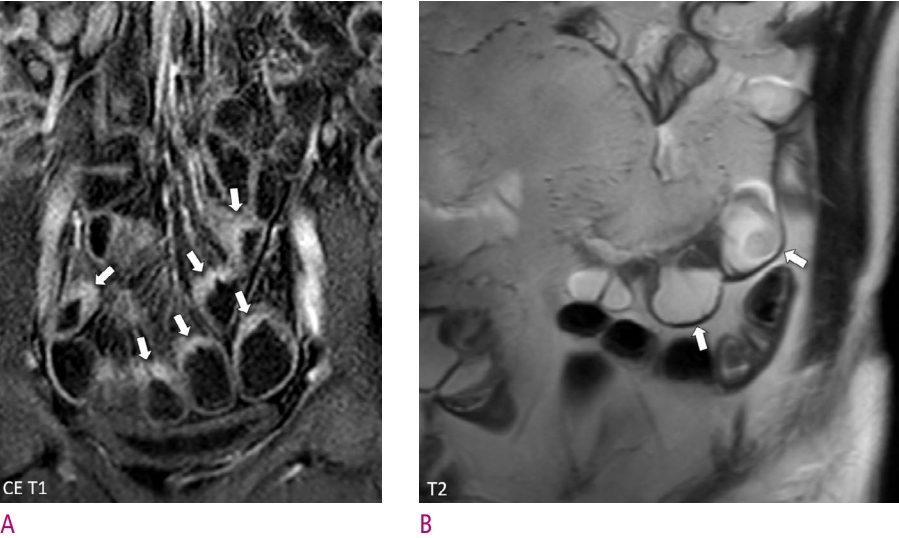
Preferential involvement of the mesenteric border in Crohn’s disease.
A . Mural thickening and hyperenhancement due to inflammation are noted in the mesenteric side of multiple distal ileal segments (arrows), whereas other parts of the bowel wall appear normal. B. Shortening of the mesenteric border alone caused by scarring associated with Crohn’s disease has created a pseudo-sacculation appearance in an ileal segment (arrows). CE T1 = contrastenhanced T1-weighted sequence; T2 = T2-weighted half-Fourier sequence
Crohn’s disease and tuberculosis in the terminal ileum showing similar enterography morphology.
Mural thickening and mild hyperenhancement in the terminal ileum (arrows) look similar between Crohn’s disease (left) and tuberculosis (middle and right). In the case in the middle, a lymph node with central low attenuation indicating necrotic lymphadenopathy (arrowhead in the inset) is noted in the adjacent mesentery, which helps to suggest tuberculosis. In the case in the right, peritoneal infiltration is noted (arrowheads) in the left upper quadrant, indicating tuberculous peritonitis.
크론병의 중증도 평가
소장조영술의 판독은 크론병의 진단뿐 아니라 크론병의 중증도 (severity)를 포함하여 궁극적으로 치료 계획을 세우는데 필요한 모든 정보를 포함하여야 한다. 크론병의 중증도 평가와 관련된 소장조영술의 판독이 여러 판독자들 또는 기관 간에 일관되게 이루어지지 않는 경우가 있다. 이는 직접적으로는 크론병 중증도의 평가를 위한 영상의학적 기준이 아직 없기 때문이고 좀 더 크게 보면 Montreal 분류와 같이 [11] 크론병의 평가 및 치료를 위한 크론병 상태에 대한 분류 체계가 만들어져 이용되고 있기는 하나 이러한 과거의 분류 체계는 최근의 내시경 및 영상기술의 발전을 반영하지는 못하며 질환에 대한 종합적인 중증도 평가에 적합하지 않아 질환의 중증도 평가 방법이 아직 명확하게 정립되어 있지 않기 때문이다. 크론병의 중증도는 장 염증의 중증도를 말하는 염증의 활동도 (activity)뿐 아니라 장 염증의 범위, 크론병으로 인한 장 손상 (damage)의 정도, 합병증의 유무 등 여러 측면에서 생각해 볼 수 있다. 장 염증의 활동도가 높다고 또는 낮다고 해서 크론병 질환의 전체적 중증도가 각각 반드시 심하다 또는 경하다고 말할 수 없다. 더구나, 장 염증의 활동도 하나만 생각하더라도, 소장조영술에 적용할 수 있는 여러 정량적 점수체계가 연구되어 있지만, 연구 외에 실제 진료에는 잘 활용되지 않고 있으며 (이에 대해서는 논문의 뒷부분에서 좀 더 자세히 설명한다) 장 염증의 활동도를 좀 더 간단하게 경증, 중등도 (moderate), 중증으로 대략 나누어 기술하려는 시도도 있지만, 아직 한 가지 방법으로 정의가 되어 있지는 않다 [6, 12-16]. 따라서, 크론병의 소장조영술을 판독할 때 크론병의 중증도에 관한 기술에 있어 어느 정도의 혼선은 불가피한 것으로 보이며, 그래도 진단정보를 명확하게 전달하기 위해서는 “크론병이 심하다 또는 경하다”라고 막연하게 이야기하는 것보다는 크론병의 중증도를 구성하는 여러 요소를 나누어 가능한 구체적으로 기술하는 것이 좋겠다.
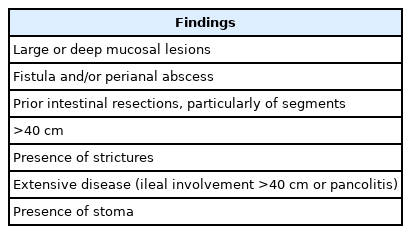
크론병의 중등도 분류에 대한 절대적인 표준은 없으나 현재로서는 최근에 나온 International Organization For the Study of Inflammatory Bowel Disease (IOIBD)의 전문가 합의가 좋은 참고가 될 수 있을 것 같다 [17]. 이 전문가 합의는 장 염증의 활동도나 범위뿐 아니라 크론병 환자의 상태에 대한 포괄적 평가를 통해 결과적으로 향후 수술, 입원 치료, 또는 장애를 초래할 위험이 큰 고위험 환자와 저위험 환자를 구분하고 고위험 환자들에게 더욱 적극적인 치료를 적용하고 있다 [17]. 고위험 환자의 기준 중 일부는 소장조영술의 소견과도 직접 관련된 것들이어서 (Table 3) 소장조영술을 판독할 때 이러한 정보들을 명확하게 포함한다면 환자 진료에 좀 더 도움을 줄 수 있을 것이다 [17].
약물치료 경과 판단
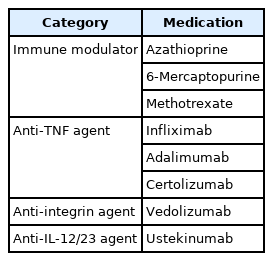
과거에는 크론병의 치료 목표가 환자의 증상 완화에 초점이 맞추어져 있었으나 현재는 면역조절제 또는 다양한 생물학적 제제를 (Table 4) 이용하여 염증을 조절하고 점막 치유를 유도 및 유지함으로써 장관 손상의 진행과 장애를 예방하는 것으로 변화되었다 [2, 3, 18]. 따라서, 치료 경과 관찰에 있어 질환의 변화를 객관적으로 보여줄 수 있는 소장조영술의 중요성이 강조되고 있다. 치료 경과 관찰을 위해서 소장조영술을 얼마나 자주 어느 시점에 시행하여야 하는지에 대해서는 아직 잘 정립되어 있지 않으며 향후 좀 더 체계적으로 정리가 되어야 할 부분이다. 내시경 검사의 시점과 빈도를 참고해 보면 [2, 3], 처음 치료를 시작하거나 치료제를 변경하고 나서 약 6-9개월 정도에 소장조영술을 이용한 평가를 고려할 수 있을 것이다. 또한, 질환의 관해가 이루어지거나 안정화가 이루어진 상황에서는 환자의 상태에 따라 1-3년에 1회 정도의 소장조영술 추적 검사를 통해 증세나 다른 검사에는 반영되지 않는 질환의 변화 여부가 있는지 확인할 수 있을 것이다. 치료 경과 관찰을 위한 목적의 소장조영술 검사의 판독에 있어 주요 평가사항은 장 염증 활동도의 변화 정도, 질환의 관해 여부, 합병증의 발생 여부 정도가 된다. 이 중 합병증에 대한 내용은 논문의 뒷부분에서 별도로 설명한다.
장 염증 활동도의 변화 평가
치료에 따른 장 염증 활동도의 감소 및 증가는 앞에서 설명한 크론병에 의한 장의 염증 소견들의 (Table 1) 변화 양상을 가지고 판단할 수 있다. 염증의 활동도와 염증의 범위가 모두 변화할 수도 있으며 염증의 범위는 큰 차이가 없이 염증 활동도만 변화할 수도 있다. 염증이 감소하면 장벽의 두께가 감소하고, T2 강조영상에서 장벽과 장 주변의 부종으로 인한 고신호강도가 감소하며, 확산강조 영상에서 확산 제한 소견도 감소한다 (Fig. 5). 영상에서 궤양을 직접 볼 수 있는 경우라면 궤양의 크기가 감소하는 것을 직접 확인할 수 있는 경우도 있다. 장벽의 조영증강 증가 소견도 염증이 감소함에 따라 일반적으로 감소하는 경향이 있으나, 장벽의 조영증강 증가는 활동성 염증 외에도 섬유화를 포함한 다양한 이유로 나타날 수 있고 조영증강의 정도는 조영제의 주입과 관련된 여러 요인, 조영제 주입 후 영상획득 시점, 환자의 혈 역학적 상태 등에 따라서도 변동될 수 있기 때문에 해석에 있어 좀 더 주의가 필요하다 [6]. 앞에서 이야기한 다른 소견들도 조영증강 정도 보다 상대적으로 덜하기는 하나 해석에 함정이 있어 주의가 필요하다. 가령, 치료로 인한 장벽 내 반흔과 섬유화로 인해서도 장벽의 두께 증가 소견이 보일 수 있으며 장이 경구 조영제로 채워져 잘 팽창되어 있지 않은 경우 확산강조 영상에서 위양성 확산 제한 소견이 보일 수 있다. 따라서, 어느 한 가지 소견에만 의존하지 않고 여러 가지 소견의 변화를 모두 같이 고려하여 종합적으로 판단하는 것이 중요하다 [5]. MR 소장조영술은 CT 소장조영술과 비교하여 평가에 사용할 수 있는 보다 다양한 소견들을 제공하므로 장 염증 활동도의 변화를 평가하는 데 좀 더 유리하다. 이러한 소견들 외에도 장의 염증이 감소할 경우 장 주변 림프절의 크기가 감소하는 것 같은 부수적인 소견들도 평가에 부분적으로 도움을 줄 수 있다.

Decreased inflammation of Crohn’s disease in the terminal ileum after treatment with azathioprine.
A. MR enterography before therapy shows remarkable thickening, high signal on T2-weighted sequence, hyperenhancement, and diffusion restriction in the wall of the terminal ileum (arrows) and high signal in the perienteric fat on T2-weighted sequence. B. MR enterography obtained after 15 months of treatment with azathioprine shows decreased thickness, signal on T2-weighted sequence, and diffusion restriction in the terminal ileal wall (arrows). Hyperenhancement of the terminal ileal wall is still similarly noted. CE T1 = contrast-enhanced T1-weighted sequence; DWI = diffusion-weighted imaging; T2 FS = T2-weighted half-Fourier sequence with fat suppression
장 염증 활동도의 감소 및 증가를 판단하는 것은 비교적 그다지 어렵지 않으나, 만일 장 염증의 활동도 변화를 좀 더 세밀하게 정량적으로 평가를 해야 한다면 평가가 복잡해진다. 이러한 평가를 위한 목적으로 소장조영술로 장 염증의 활동도를 정량적으로 측정하기 위한 다양한 점수체계가 제시되었다. MR index of activity (MARIA), Crohn’s disease MRI index (CDMI), Nancy score, Simplified MARIA 등이 상대적으로 좀 더 많이 알려진 점수체계들이다 [12-16]. 이러한 점수체계는 잠재적인 장점과 유용성을 가지고 있다. 특히, 크론병의 장 염증 활동도를 서로 다른 환자들 사이에서 일관되게 평가, 구분, 비교하는 데 도움을 줄 수 있을 것이다. 가령 혈액검사 결과처럼 장 염증 활동도의 정도를 숫자로 제시하고 점수의 범위에 따라 경증, 중등도, 중증을 나누는 방법을 적용해 볼 수 있을 것이다. 하지만 실제로는 여러 제약으로 인해 이러한 점수체계들은 거의 연구에서만 사용되며 임상 진료에는 잘 이용되지 않고 있다 [4, 5]. 먼저, 이들 점수는 측정을 시행하는 해당 부위에 부여되는 값으로 장의 어느 부위에서 점수를 매기는지에 따라 값이 변할 수 있다. 커다란 고형장기나 종괴와는 달리 크기가 작은 장벽에서 측정을 하는 것은 쉽지 않으며 오류가 발생할 수 있다. 일부 정량적인 측정치는 영상획득의 세부 조건들에 따라 값이 달라질 수 있다. 또한, 이러한 정량적 평가는 영상의학의 일반적 판독 업무 환경 및 상황과는 약간 차이가 있어 판독 업무 흐름에 방해를 주지 않는 방식으로 도입을 하려면 별도의 고려가 필요하다. 이러한 이유로 정량적 평가에 영향을 줄 수 있는 여러 요인이 잘 관리될 수 있는 연구 환경이 아닌 일반 진료 환경에서는 이 점수체계들을 연구 환경처럼 정확하고 일관되게 널리 사용하기는 어렵다. 또한, 여러 서로 다른 점수체계가 있다는 것은 어떤 점수체계도 만족스럽지 않다는 것을 보여주는 것으로 생각할 수도 있다. 이러한 제한점들을 극복하고자 과거 점수체계인 MARIA를 좀 더 쉽게 개선한 Simplified MARIA를 만드는 노력도 있었는데, 향후 정량적 점수체계가 임상 진료에 도입될 수 있을지는 좀 더 두고 보아야 한다 [12, 16].
관해의 평가
소장조영술에서 어떠한 소견을 크론병의 관해로 보아야 할지는 아직 분명히 정립되지 않았다. 이는 부분적으로는 크론병의 관해에 대한 정의가 현재 하나로 정해져 있지 않기 때문이다. 현재 관해를 판단하는 일반적인 기준은 내시경적 관해에 해당하는 점막 치유이다. 내시경적 관해가 된 예들의 소장조영술 소견에 대해서는 보고된 연구들이 있다. 내시경적 관해를 보이는 환자들의 대다수는 염증으로 인한 장벽의 비후, 비정상 신호강도, 그리고 조영증강 증가 소견이 모두 소실되어 장벽이 사실상 거의 정상으로 보이게 된다 (Figs. 6 and 7). 다만 장벽의 이상 소견들이 모두 소실되더라도 염증 후 남아있는 약간의 반흔으로 인해 장의 윤곽은 약간 변형될 수 있다 (Fig. 7). 반면, 내시경적 관해가 된 환자 중 많게는 약 30-40% 정도의 환자에서 점막 치유에도 불구하고 장벽의 이상 소견이 MR 소장조영술이나 CT 소장조영술에 어느 정도 계속 남아 있는 것으로 알려져 있다 [19-21]. 이처럼 장벽의 이상소견이 남아 있다하더라도 치료 전보다는 감소한 상태로 대부분의 경우에는 경미한 장벽의 비후, 비정상 신호강도, 또는 조영증강 증가로 보이는데 (Fig. 8) 드물게 심한 이상 소견이 남아 있는 경우도 있다.

MR enterography findings of endoscopic mucosal healing of Crohn’s disease in the ascending colon after treatment with 6-mercaptopurine.
A. MR enterography before therapy shows inflammatory changes in the medial wall of the ascending colon and adjacent pericolic area due to inflammation (arrows), as shown on the colonoscopic image (left). B. All the inflammatory findings have resolved at MR enterography (arrows) with the achievement of endoscopic remission after a 1-year treatment with 6-mercaptopurine. The figure is from Park et al. (5) with permission. CE T1 = contrast-enhanced T1-weighted sequence; T2 FS = T2-weighted half-Fourier sequence with fat suppression
CT enterography findings of endoscopic mucosal healing of Crohn’s disease in the distal ileum after treatment with infliximab and azathioprine.
Inflammatory changes are noted in the mesenteric side of the pelvic ileum before treatment (arrows in the left). The inflammatory findings have completely resolved after a 2-year treatment with infliximab and azathioprine, leaving shortening and flattening of the bowel contour (arrows in the right) due to scarring.

Subtle residual mural abnormalities at MR enterography despite endoscopic mucosal healing of Crohn’s disease.
Endoscopy of the neo-terminal ileum (left; status post ileocecal resection) shows no demonstrable inflammation, whereas MR enterography shows slight mural thickening and hyperenhancement (arrows in the right). The mural signal on the T2-weighted sequence is only slightly increased (arrows in the middle). CE T1 = contrast-enhanced T1-weighted sequence; T2 FS = T2-weighted half-Fourier sequence with fat suppression
내시경적으로 관해가 된 장을 수술로 절제해서 분석해 보거나 할 수는 없기 때문에, 내시경적 관해에도 불구하고 소장조영술에 남아 있는 장벽의 이상소견이 병리학적으로는 어떤 상태인지 정확히 알기는 어렵다. 한 연구는 간접적인 자료 분석을 통해 이처럼 남아 있는 장벽의 이상 소견이 치유된 점막 아래에 숨어 있는 염증이라기보다는 크론병으로 인한 장 손상의 소견일 것이라 제시하였다 [19]. 내시경적 관해와 더불어 소장조영술에서도 장벽의 이상소견이 모두 소실된 경우를 내시경적 관해인 점막 치유와 구분하여 전 층 (transmural) 치유 또는 관해라 하는데, 한 연구에 따르면, 내시경적 점막 치유는 되었으나 MR 소장조영술에서 장벽에 이상이 남아 있는 환자들이 전 층 치유가 된 환자들에 비해서 향후 추적 관찰에서 크론병으로 인한 수술, 입원, 그리고 약물치료를 강화하게 되는 위험이 더 높아 나쁜 경과를 보였다 [22].
수술 후 재발 평가
크론병 환자의 수술 후 경과 관찰에 있어 별도의 고려가 필요한 부분은 수술 후 병변의 재발을 발견하기 위한 조기 검사와 관련된 것이다. 크론병으로 장 절제 수술을 받은 환자에서 수술 후 크론병의 재발이 흔하게 일어나는 것으로 알려져 있으며, 많은 환자에서 수술 후 조기에 재발이 나타난다. 한 메타분석에 따르면, 무작위 임상시험의 결과를 종합하여 보았을 때 54%의 환자에서 수술 후 1년 이내에 내시경에서 재발이 확인되었으며 이 중 약 절반의 환자가 임상적으로 재발을 의심할 만한 증상이나 다른 소견이 없었다 [23]. 따라서, 크론병으로 장 절제 수술을 받은 환자들에 대해서 재발이 의심되는 증상이 보일 때까지 기다리지 말고 수술 후 6개월 정도에 대장내시경으로 먼저 적극적으로 검사를 할 것이 권고된다 [24, 25]. 이른 시기에 무증상 환자에서 적극적으로 검사를 시행하여 재발을 일찍 발견하고 적절히 치료를 시행하면 환자의 예후를 향상시킬 수 있다 [26]. 크론병으로 장 절제 수술을 받은 경우 재발은 문합 부위 주변에 잘 발생한다. 크론병으로 인한 장 절제 수술의 대표적인 형태는 회맹판을 포함하여 소장과 대장의 일부를 절제하고 소장과 대장간 문합을 만드는 수술인데 이때 문합부의 소장 쪽으로 크론병이 재발하는 특징이 있다.
수술 후 이른 시기에 증상과 무관하게 소장조영술 검사를 시행하는 것에 대한 연구 결과는 많지 않다. 크론병으로 장 절제술을 받은 환자의 검사를 위해 소장조영술을 이용한 대부분의 연구는 재발이 의심되는 증세를 보이는 환자를 대상으로 하거나 수술 후 좀 더 늦은 시기에 소장조영술을 이용한 연구들이다. CT 소장조영술을 수술 후 1년 이내에 증상과 무관한 검사로서 이용하는 것을 분석한 한 연구에 따르면 소장-대장 문합부 근처의 크론병 재발 진단에 있어 CT 소장조영술의 예민도와 특이도는 각각 92%와 83%이었다 [27]. 소장조영술을 수술 후 이른 시기에 시행하는 경우 판독에 있어 눈여겨보아야 할 점은, 앞서 이야기한 것처럼 재발이 소장-대장 문합부의 소장 쪽에 발생한다는 점과 (Fig. 9) 재발 초기의 병변은 경미한 이상소견 만을 보일 수 있다는 점 정도로 생각된다 (Fig. 9A).
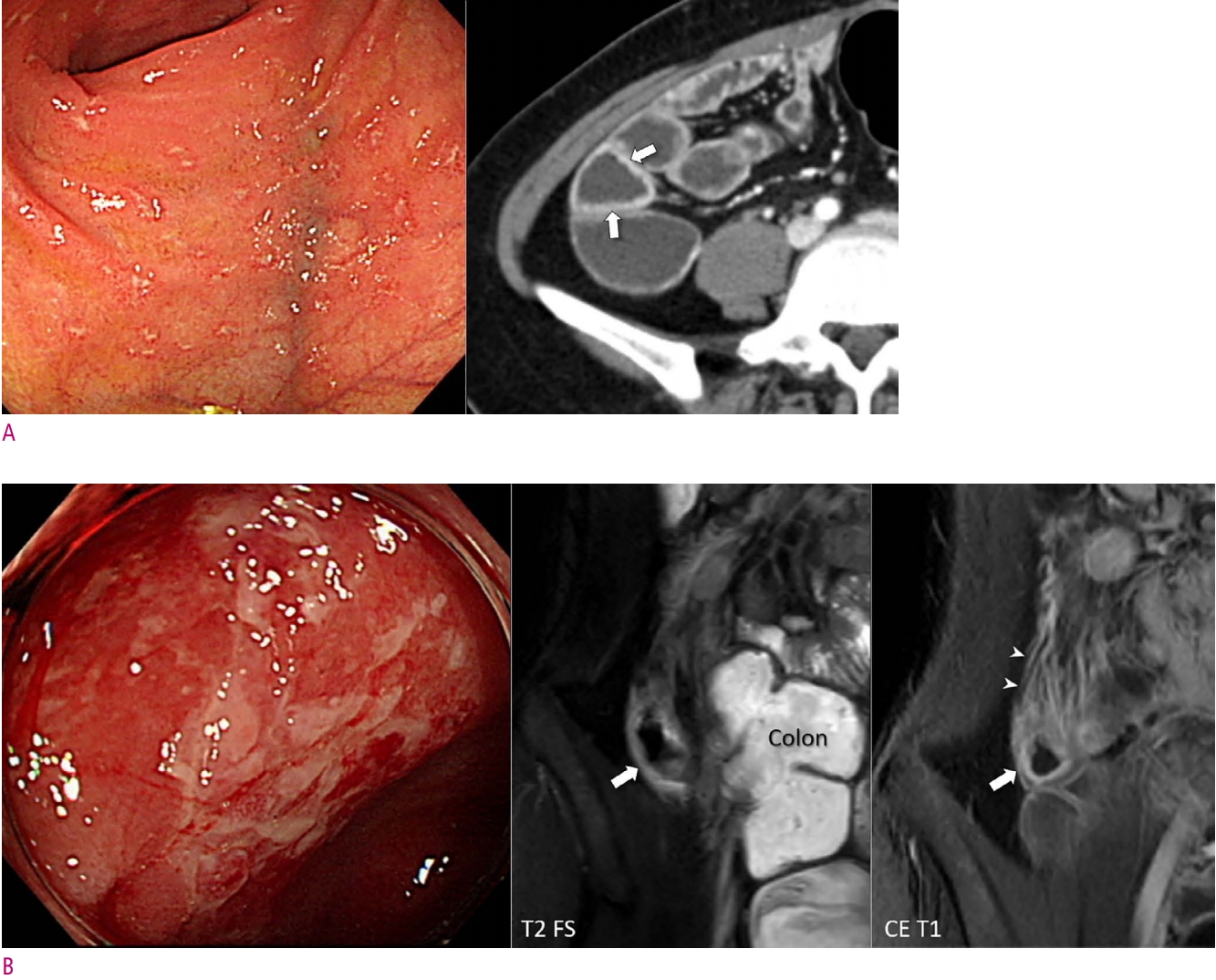
Examples of recurred Crohn’s disease near the ileocolic anastomosis.
A. CT enterography shows slight wall thickening and mural hyperenhancement in the neo-terminal ileum (arrows). Endoscopy image shows numerous scattered aphthoid lesions, which corresponds to Rutgeert i2. B. MR enterography in another patient shows more severe inflammatory changes than the patient in A in the wall of the neo-terminal ileum (arrows) and engorged vasa recta (arrowheads). Endoscopy image shows more severe inflammation and ulcerations than the patient in A, which corresponds to Rutgeerts i3. CE T1 = contrast-enhanced T1-weighted sequence; T2 FS = T2-weighted half-Fourier sequence with fat suppression
질환의 악화가 의심되는 경우
장 염증의 증가, 합병증의 발생, 다른 질환의 발생 등 다양한 가능성에 대해서 영상소견을 잘 확인하여야 한다. 크론병 자체의 변화에 대한 평가는 앞의 설명을 보기 바라며 합병증의 평가에 대해서는 뒤에서 설명한다. 크론병에 대한 평가와 더불어 복부 및 골반의 다른 여러 질환 유무에 대한 평가가 같이 이루어져야 한다. 단지 영상만 보고 판독하는 것보다는 환자의 증세를 확인하고 증세를 설명할 만한 영상 소견이 있는지 확인을 해 보는 것이 좋다.
합병증의 평가
크론병의 대표적인 합병증은 장 협착과 누공이다. 크론병 장 염증의 활동도와 합병증은 분리하여 생각하고 기술하여야 한다. 합병증은 장 염증의 활동도 보다는 장손상의 소견이다. 심한 장 염증이 지속되면 장손상과 이로 인한 합병증의 발생 위험이 증가한다. 하지만 합병증이 있다고 해서 현재 장 염증이 반드시 심하게 있는 것은 아니며 합병증이 새롭게 발생하였다고 해서 반드시 장 염증의 활동도가 증가한 것은 아니다. 가령, 장 염증이 치료되는 과정에서 반흔이 증가하면서 장 협착이 발생할 수도 있다. 또한, 장-장 누공이 형성된 경우에도 염증의 활동도는 그다지 높지 않고 누공만 유지될 수도 있다.
장 협착
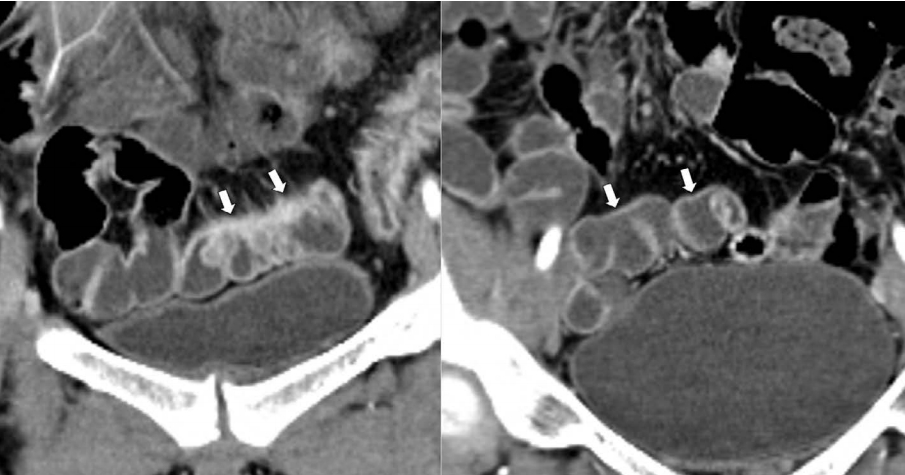
크론병에서 장 협착은 염증에 의한 점막 부종 또는 만성적 염증으로 인한 장벽 내 섬유화에 의해 발생할 수 있다. 소장조영술을 판독할 때 장 협착에 대한 해석을 보다 일관되게 할 수 있도록 최근 전문가 협의를 거쳐 장 협착의 영상의학적 기준이 제시되었는데, 소장조영술에서 소장의 협착은 내강이 좁아진 소장 분절의 상방으로 소장의 너비가 3 cm 이상으로 늘어나 있을 때로 정의된다 [6]. 이는 특이도가 높은 기준으로 위양성의 가능성은 매우 낮으나 상대적으로 예민도는 높지 않아 실제 증상을 유발하는 소장 협착이 이 기준을 만족하지 않을 수도 있다. 따라서, 상방 소장의 너비가 3 cm를 넘지는 않지만, 소장 내강이 좁아진 부위가 하나의 정지 영상이 아닌 영화 영상 (cine), 여러 영상 시퀀스, 또는 추적 검사 결과에서 변함없이 보일 경우 장 협착 의심 (probable stricture) 이라고 별도로 이야기한다 [6]. 대장의 경우 상부 대장의 확장 및 수분, 공기 및 대변의 저류 소견으로 판단할 수 있으나 소장의 협착과는 달리 대장의 협착에 대한 영상의학적 기준이 하나로 마련되어 있지는 않다.
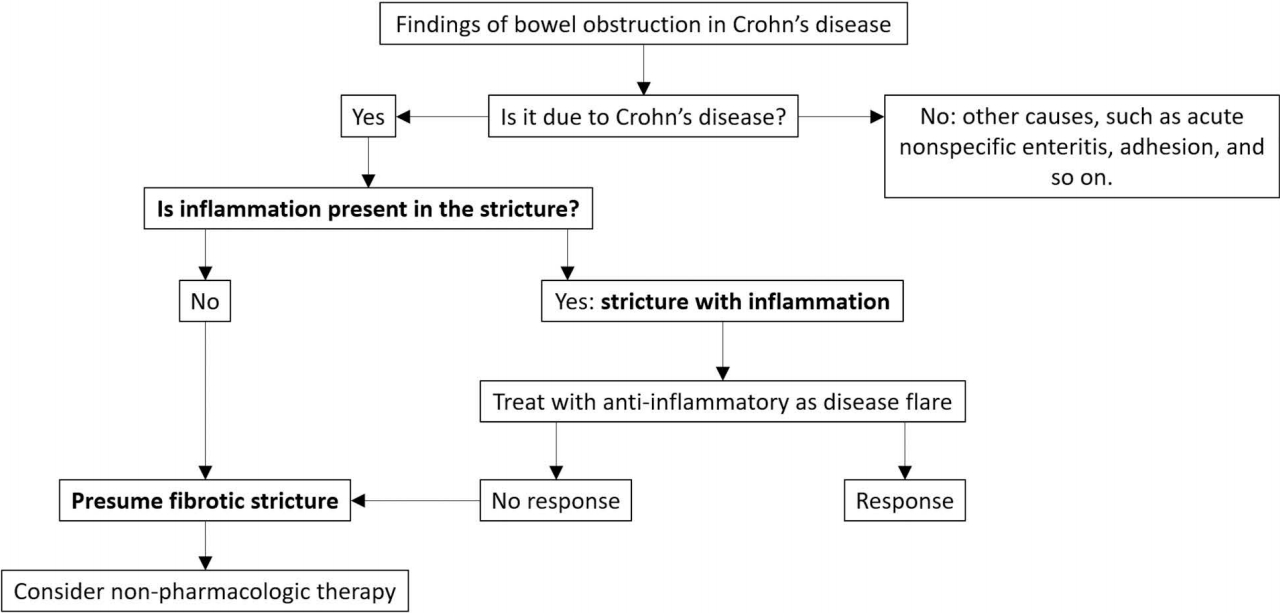
크론병 환자에서 다양한 급성 감염성 장염과 같은 비특이적 염증이 동반되거나 유착과 같은 다른 원인으로도 크론병으로 인한 장 협착과 비슷한 증세를 유발할 수 있다. 따라서, 장 협착이 의심되는 크론병 환자의 영상 검사를 판독할 때 먼저 이러한 다른 원인이 있는지 확인을 하여야 한다 (Fig. 10) [28]. 장 협착이 의심되는 크론병 환자들의 경우 급성 복통으로 인해 응급실을 방문하여 CT로 검사를 하는 경우가 많은데, 일반적으로 장벽의 조영증강이 두드러지게 보이는 크론병의 염증과는 달리, 비특이적 급성 장염의 경우에는 장벽의 부종으로 인해 CT에서 두꺼워진 장벽이 전체적으로 균일하게 저음영을 보이는 차이가 있다(Fig. 11). 크론병으로 인한 장 협착이 확인되면 약물에 의한 치료가 가능한 주로 염증으로 인한 협착인지 수술이나 내시경 풍선확장술과 같은 비약물적 치료가 필요한 섬유화로 인한 협착인지 구별을 하여야 한다 (Fig. 10). 협착 부위에 T2 강조영상에서 높은 신호강도가 보이면 염증을 시사하는 소견이고 혈관 내로 조영제 주입 후 지연기 영상에서 두드러진 조영증강이 있으면 섬유화를 시사하는 것으로 일반적으로 알려져 있으나 이러한 구분이 항상 잘 맞는 것은 아니며 실제로는 대부분의 환자에서 염증과 섬유화가 다양하게 섞이어 있기 때문에 구별이 어려운 경우가 많다 [29-33]. 탄성 영상 및 자화전이 영상을 이용하여 크론병으로 인한 장 벽 내 섬유화를 평가해 보려는 연구들도 보고되어 있기는 하지만 아직은 실험단계이다 [34-39]. 따라서, 현재로서는 크론병으로 인한 협착 부위의 섬유화 정도를 잘 평가할 수 있는 적절한 영상 방법이 없는 상태이다. 이러한 영상진단의 제한점 들과 크론병의 치료에 있어 장 수술을 가급적 최소화 하려는 원칙을 고려할 때, 크론병으로 인한 장 협착을 염증형 협착과 섬유형 협착으로 배타적으로 구분하려 하는 것보다는, 염증이 동반된 협착과 염증이 동반되지 않은 협착으로 구분하는 것이 더 효과적이다 (Figs. 10 and 12) [28]. 염증이 동반된 협착에 대해서는 먼저 약물치료를 시도해 보고 효과가 없으면 비약물적 치료로 진행하는 접근이 권고된다 (Fig. 10) [28].

Small bowel obstruction due to nonspecific acute enteritis in a patient with Crohn’s disease.
A. CT at presentation shows dilated small bowel segments and small bowel feces sign (thin arrow). The thick arrow points to the level of obstruction (the exact obstruction site is not completely included in this image due to the curved configuration of the bowel). The dashed arrow shows the course of the bowel. The wall of the long bowel segment just distal to the obstruction site shows mild diffuse thickening with low attenuation (arrowheads) due to edema. B. CT obtained after 4 days of general management with intravenous fluid and cessation of oral intake shows resolution of small bowel obstruction. The previous obstruction site (arrow) shows a slight wall thickening and mild luminal narrowing, presumably as an underlying change from the previous involvement of Crohn’s disease. The patient was free of any findings of bowel stricture or obstruction for the next 2 years.
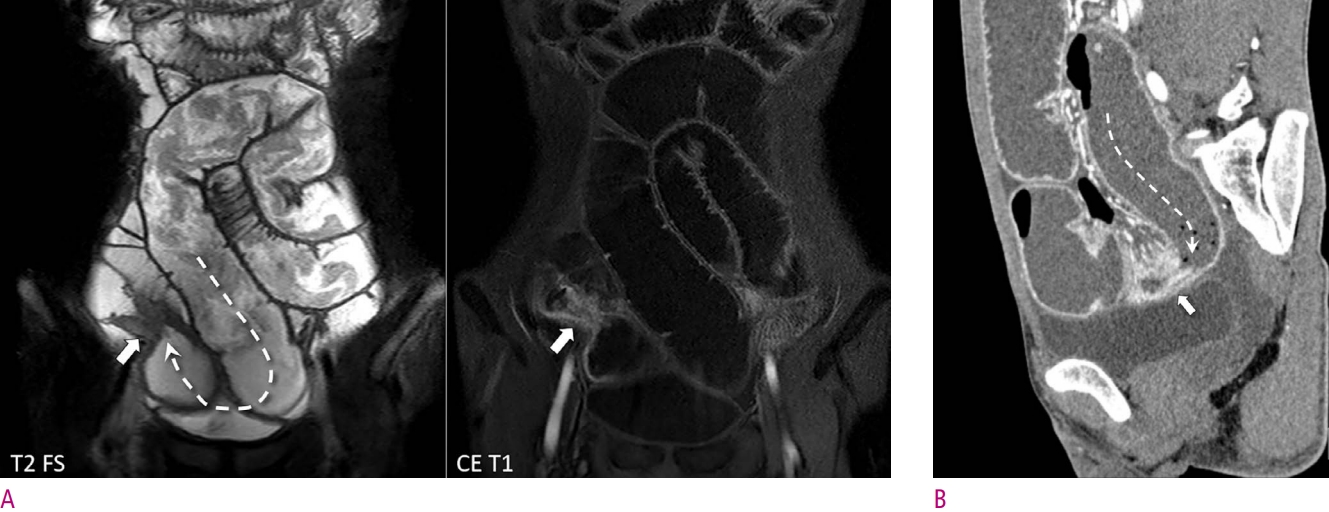
Stricture with inflammation (not inflammatory stricture) in the ileum due to Crohn’s disease.
A. MR enterography shows a short-segmental ileal stricture (arrows) causing an obstruction. The dashed arrow shows the course of the bowel. The stricture shows several findings of inflammation, including wall thickening with high signal intensity on T2-weighed sequence and hyperenhancement. The figure is in part from Park et al. (5) with permission. B. Follow-up CT obtained a month later after anti-inflammatory medical therapy shows no improvement of the bowel obstruction (arrow), indicating irreversible nature of the stricture. The dashed arrow shows the course of the bowel. It is a stricture with inflammation instead of an inflammatory stricture. CE T1 = contrast-enhanced T1-weighted sequence; T2 FS = T2-weighted half-Fourier sequence with fat suppression
장 누공
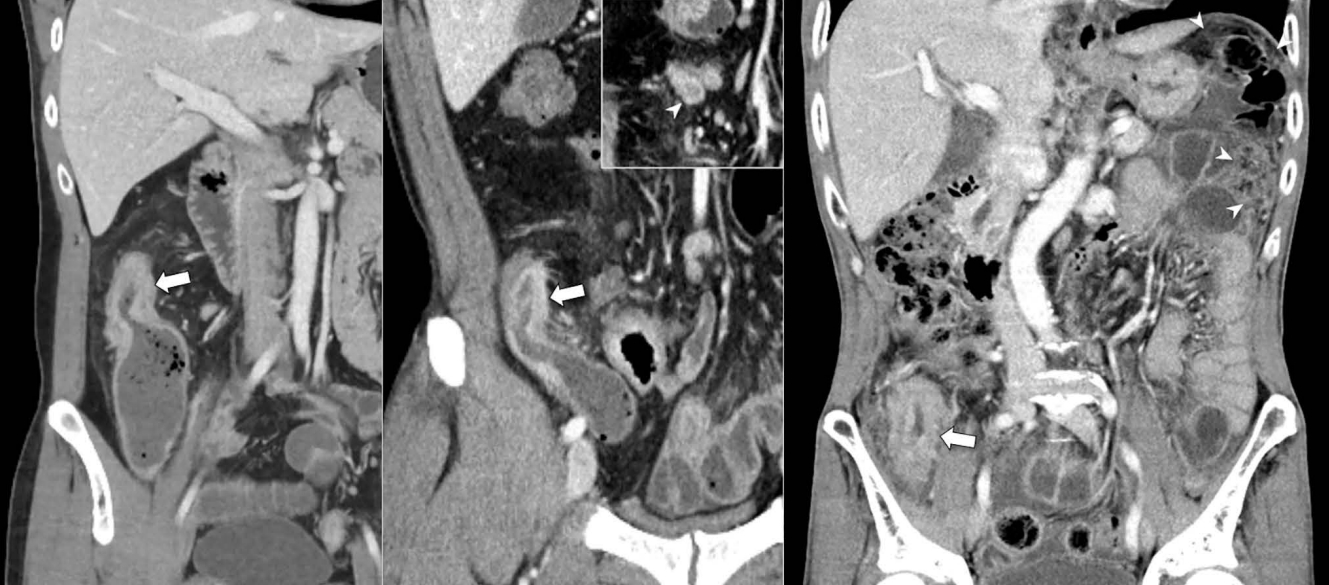
크론병으로 인한 장 누공은 크론병에서 높은 빈도로 동반되는 합병증으로 장 협착과 동반되는 경우가 많다 [40]. 크론병으로 인한 장 누공은 장 천공과 구분되어야 한다. 후자는 복강 내로 유리된 공기 및 복막염을 동반하는 경우를 말하며 크론병에서는 드물게 발생한다. 이와는 달리, 장 누공은 복강 내로 유리된 공기나 복막염의 소견은 드물며 장 주변 지방조직에 누공에 의한 염증성 종괴 또는 농양을 형성하거나 인접 장기나 구조물까지 누공이 진행되어 연결될 수 있다 (Fig. 13). 염증성 종괴는 고형상태의 염증성 병변을 말하며 농양은 내부에 액상의 저류나 공기가 있고 이를 둘러싸는 가장자리로 조영증강을 보이는 형태의 병변을 말한다 (Fig. 14). 염증성 종괴는 농양과는 달리 배액술의 대상이 아니며 두 경우에 대한 치료가 다를 수 있기 때문에 구분해서 판독하는 것이 중요하다. 영어에 phlegmon이란 단어가 있는데 둘 중 어떤 경우를 이야기하는지 모호하기 때문에 사용하지 않는 것이 좋다 [6, 7]. 이러한 병변들을 모두 통상 누공이라고 이야기하지만, 영어로는 상피세포로 둘러싸인 장기나 구조물 간에 연결이 생긴 경우 (예, 장장 누공, 장-방광 누공, 장-피 누공 등)를 fistula라고 하고 단지 장 주변 지방조직으로만 누공이 연장된 경우를 sinus tract이라 하여 구분한다 (Fig. 13) [6, 7]. 그리고 fistula와 sinus tract를 모두 포함하는 용어로 penetration을 사용한다. 인접한 소장 분절 사이에 누공이 생긴 경우보다 소장으로부터 에스결장, 십이지장, 방광, 피부와 같이 기능적으로 크게 분리된 부위나 위장관 외 장기로 누공을 만든 경우 특히 더 문제가 될 수 있다. 따라서, 이러한 소견들이 있는지 주의 깊게 보아야 한다.
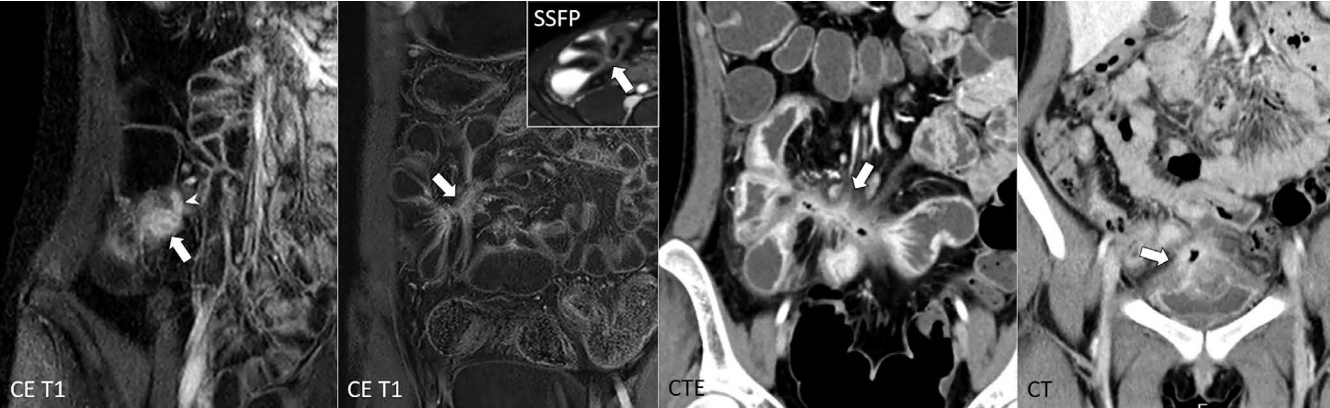
Examples of enteric penetration in Crohn’s disease.
From left to right, a small sinus tract (arrowhead) from the inflamed terminal ileum (arrow), enteroenteric fistula (arrow) associated with only mild inflammatory change (i.e., no peri-tract edema on the inset SSFP), enteroenteric fistula with remarkable inflammation around the tract (arrow), and enterovesical fistula (arrow) are shown. CE T1 = contrast-enhanced T1-weighted sequence; CTE = CT enterography; SSFP = steady-state free precession sequence
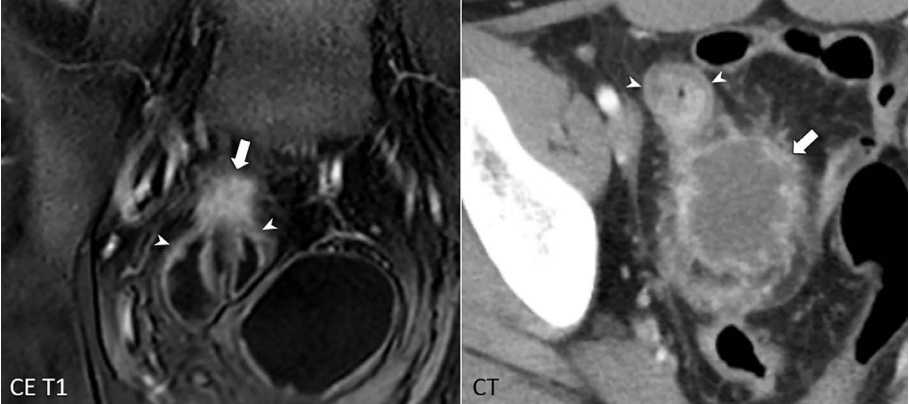
Inflammatory mass and abscess associated with bowel penetration in Crohn’s disease.
From left to right, an inflammatory mass appearing as a solid enhancing nodule (arrow) and an abscess with a lowattenuating center surrounded by an irregular enhancing rim (arrow) are shown adjacent to inflamed bowel segments due to Crohn’s disease (arrowheads).
결 론
이 논문은, 크론병의 진단과 치료에 대한 현재의 최신 지식에 맞추어 MR 소장조영술을 중심으로 크론병 환자의 소장조영술 판독을 위한 실용적인 핵심 사항들을 대표적 영상 예들과 함께 설명하였다. 크론병과 관련된 소장조영술 판독은 유사 질환과의 감별을 포함한 크론병의 진단, 크론병의 중증도 평가, 합병증의 평가 등 다양한 구성요소를 포함한다. 환자 진료에 더욱 도움이 되는 효과적인 판독과 영상정보의 제공을 위해서는 소장조영술을 하게 된 임상적 맥락을 고려해야 하고 보다 일관되고 표준화된 판독이 되도록 노력하여야 한다. 이 논문의 설명이 도움이 되었을 것으로 생각한다.