서 론
조영증강초음파 (contrast-enhanced ultrasound)는 미세기포를 조영제로 사용하여 폐로 대사되는 특징이 있어 신기능 저하 환자에서 안전하게 사용할 수 있고, 방사선 노출이 없으며, 갑상선 기능에 방해가 없고, 조영제 과민반응이 요오드 보다 낮다는 장점이 있다[1-3]. 또한, 혈역학적(hemodynamic) 정보를 실시간으로 평가할 수 있어 CT 혹은 MRI 검사에서 실제 동맥기 및 문맥기와 영상획득 시각의 차이로 발생하는 오류를 최소화 할 수 있다. 초음파 조영제는 혈관 내피 (vascular endothelium)를 통과하지 못하여 세포 간질로의 조영제 이동이 없어, 순수한 혈관 영상을 생성하므로, CT 혹은 MRI 검사와 차별화 되는 영상 소견을 보인다. 이러한 조영증강초음파의 고유한 특징들은 간세포암 진단에 유용하게 사용될 수 있다. 이 논문에서는, 조영증강초음파의 원리, 특징 및 간세포암의 진단 기준에 대해 논의하고자 한다.
조영증강초음파의 원리
초음파 조영제는 구형의 지질 혹은 알부민 외피 내부에 용해도가 낮은 기체를 포함하여 구성된 미세기포이다. 일반적으로 초음파 영상은 probe에서 발생한 초음파가 조직에 도달하여 진동 (oscillation)을 만들고, 이때 반사되어 돌아오는 반사파를 영상화 하는 원리이다. 이 진동은 선형진동 (linear oscillation)으로 입사된 초음파와 선형 관계의 반사파를 발생시킨다. 반면 초음파 조영제의 경우, 미세기포에 초음파가 도달하면 공명 (resonance)을 통해 미세기포 자체에서 압축과 확장을 반복하며 비선형진동 (non-linear oscillation)이 발생하게 되어, 다른 주파수를 가진 반사파를 발생시킨다. 조영증강초음파 영상은 미세기포에서 발생하는 비선형 반사파에서 조직에서 발생하는 선형 반사파를 구분하여 시각화 한 영상이다[4]. 비선형 반사파를 구분하기 위해 선형 반사파를 상쇄시키는 방법은 pulse inversion 방식과 amplitude modulation 방식이 있다. Pulse inversion 방식은 입사파와 정반대의 극성 (polarity)을 가진 파를 이용하여 선형 반사파를 상쇄시키고 비선형 반사파의 진폭은 증가시키는 원리이다. Amplitude modulation 방식은 입사파의 정배수의 진폭을 가진 파를 이용하여 선형 반사파를 상쇄시키고 비선형 반사파의 진폭은 증가시키는 원리이다[5].
조영증강초음파에 사용되는 Mechanical Index (MI) 값은 0.1-0.3 구간이다. 이는 일반적인 B-mode 초음파의 MI 값보다 낮은 값으로 조직에서 발생하는 선형 반사파를 최소화 하고, 미세기포의 파괴를 최소화 하기 위함이다. 반대로 너무 낮은 MI값을 사용하게 되면, 미세기포가 선형 진동을 보이게 되므로 적합하지 않다[6]. 일반적으로 초음파 기계 및 프로그램에서 사용하는 매개 변수 값에 따라 다르지만, 부드러운 외피로 이루어진 소노뷰는 주로 0.1 근처 MI 값을 사용하고, 비교적 경도가 높은 외피로 구성된 소나조이드는 0.15-0.2 정도의 MI값을 사용한다[7].
초음파 조영제
간에 사용되는 초음파 조영제는 크게 두 종류로, 순수혈관조영제 (pure-vascular agent)와 Kupffer 조영제(Kupffer agent)로 나뉜다. 순수 혈관 조영제 중 현재 전세계적으로 가장 널리 쓰이는 초음파 조영제는 소노뷰(SonoVue, Bracco)이다. 인지질 (phospholipid) 외피 내에 Sulfur Hexafluoride 가스를 포함하고 있다. 소노뷰의 직경은 1.5-2.5 ㎛로 적혈구와 비슷한 크기로 CT 혹은 MR 조영제보다 크고, 혈관 내피 (vascular endothelium)를 통과하지 못하여 세포 간질로의 조영제 이동이 없어, 순수한 혈관 영상을 생성한다[7]. 조영증강초음파 검사에서 간의 동문맥단락 (AP shunt) 같은 혈관가양성병변 (vascular pseudolesion)을 보이지 않는 것도 같은 이유에서이다.
Kupffer 조영제는 소나조이드 (Sonazoid, GE healthcare)가 대표적이며, 한국, 일본, 중국, 대만, 노르웨이에서 사용된다. 인지질 외피 내에 Perfluorobutane 가스를 포함하고 있다. 소나조이드의 직경은 2.1-2.9 ㎛로 소노뷰와 마찬가지로 혈관 내피를 통과하지 못하여 혈관 영상을 생성함과 동시에, 간 내 대식세포인 Kupffer 세포에 포식되어 간 실질에 수 십 분간 이상 지속되는 echogenicity를 나타내는 특징을 가지고 있다. Yanagisawa 등[8]의 In vitro 실험에 따르자면 소나조이드 주입 후 1분 경과 후 Kupffer 세포가 위족 (pseudopodia)을 만들어 소나조이드 bubble을 둘러싸고, 5분 경과 후 소나조이드가 포식된 것을 관찰하여 보고한 바 있다. 따라서 소나조이드를 이용한 조영증강초음파 영상은, 혈관기 (vascular phase) 이후 Kupffer 세포 포식에 의해 echogenicity를 보이는 Kupffer기 (Kupffer phase)가 있으며, 통상 조영제 주입 후 10분 이후의 시기를 의미한다[9].
조영증강초음파 검사 방법
조영제 종류에 상관없이 검사법은 유사하다. 준비물은 초음파 조영제, 생리식염수, 5 mL 및 10 mL 주사기, 조영제 주입을 도와줄 의료진 1인, 피검사자의 IV line이다. 조영제 제조사의 권고사항에 따라 조영제 용매와 용질을 혼합한다. 피검사자의 체중에 맞추어 적정 조영제양을 주사기 담고, 10 mL 주사기에 생리식염수를 담아 준비한다. B-mode 초음파로 대상 병변을 확인하고, 피검사자의 IV line을 확인한다. 이 때 IV line의 카테터와 약물 주입구가 너무 가까운 것은 되도록 피하는 것이 좋다. 피검사자는 안정된 상태에서 되도록 얕은 숨을 쉴 수 있도록 안내한다. 초음파 기계의 프로그램을 조영증강초음파 모드로 변경한 후, 대상 병변 관찰에 적합한 위치에 초음파 probe를 위치하고, 조영제 주입을 담당한 의료진이 IV line에 조영제를 채운다. 이후 생리식염수 10 mL를 빠르게 주입하며(flushing), 이와 동시에 초음파 기계 패널의 timer를 시작한다. 처음 60-70초 간은 동영상으로 영상을 저장하며, 이후에는 15-30초 정도의 간격으로 간헐적 스캔을 한다. 순수혈관조영제의 경우 조영제가 대부분 파괴되는 5분까지 검사를 시행하며, Kupffer 조영제의 경우 Kupffer기 확인을 위해 10분 이후까지 검사를 시행한다.
조영증강초음파의 간세포암의 진단
(1) 순수혈관조영제를 이용한 간세포암 진단
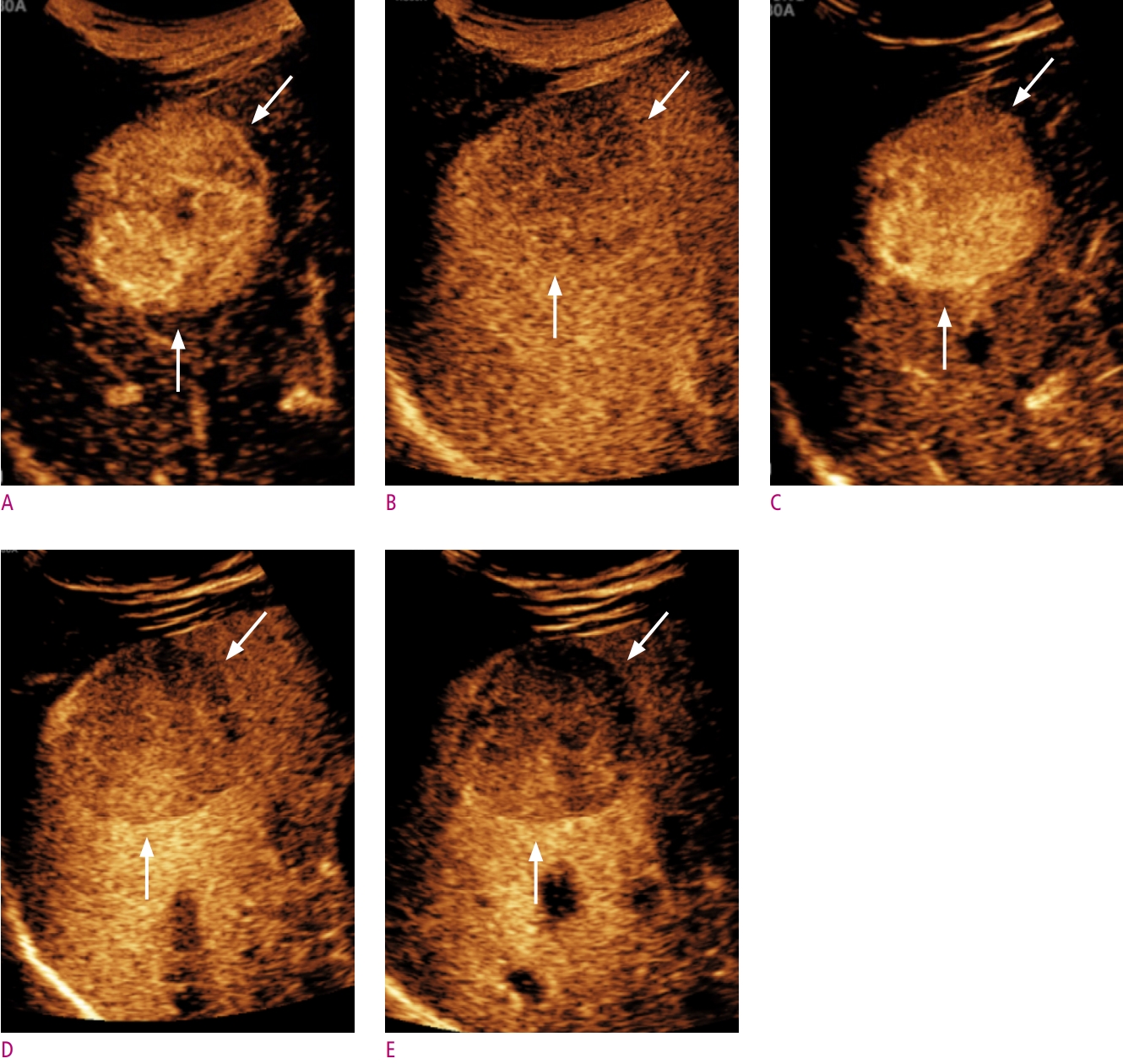
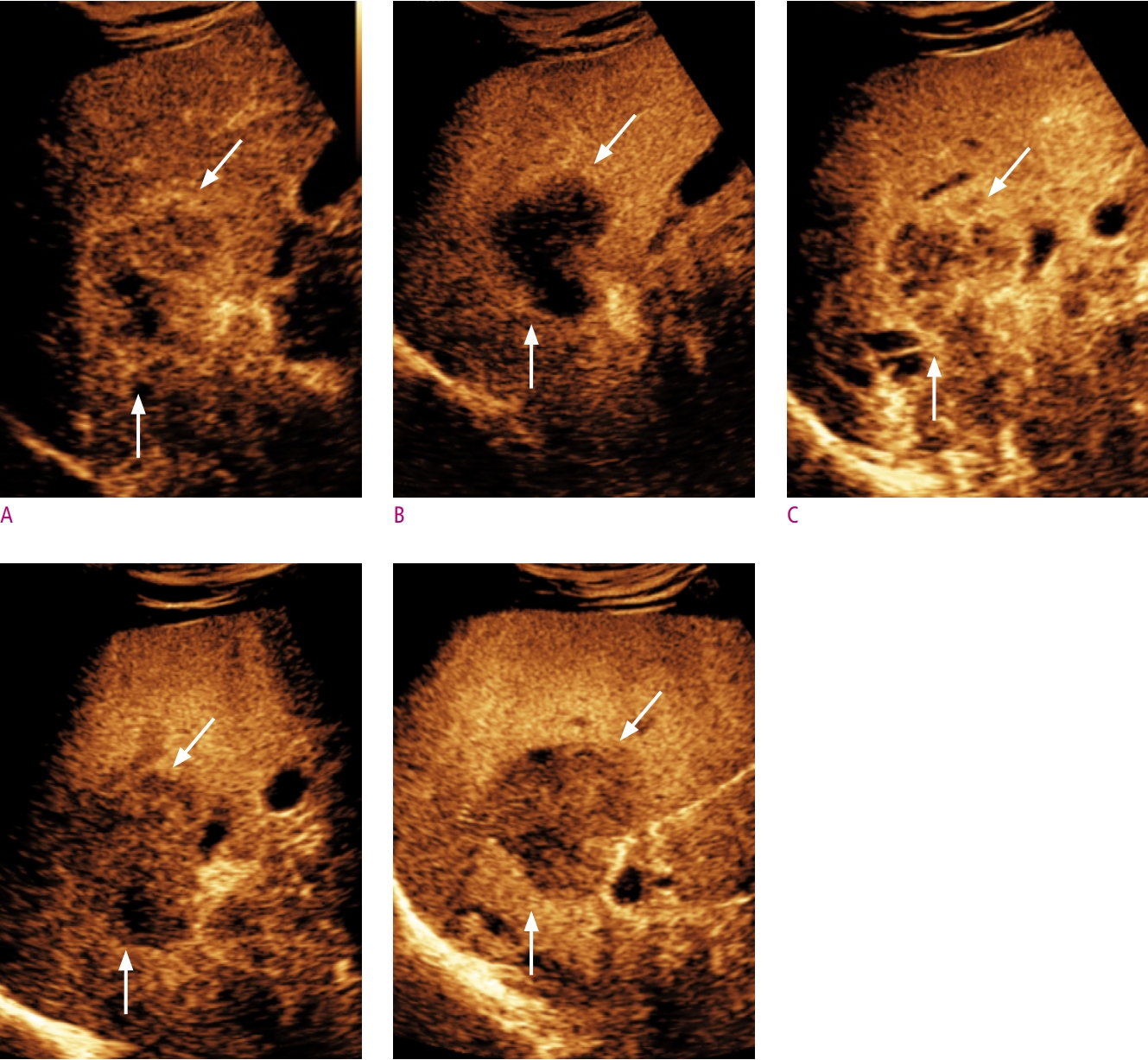
CT, MRI와 마찬가지로 조영증강초음파 또한 간세포암 고위험군에서 특징적인 영상 소견을 바탕으로 간세포암을 비침습적으로 진단할 수 있다[10]. 2017년 American College of Radiology에서 발표한 조영증강초음파 Liver Imaging Reporting and Data System (LI-RADS)에 따르면, 간세포암 고위험군에서 동맥기 조영증강 (arterial phase hyperenhancement, APHE)을 동반한 1 cm 이상의 결절에서 60초 이후에서 보이는 경도 (mild)의 씻김(washout)이 있을 경우 LR-5 (definitely HCC) category로 분류하며 비침습적 간세포암 진단이 가능하다 (Fig. 1). 씻김의 정도 (degree)는 초음파 조영제 주입 2분에 평가한다.
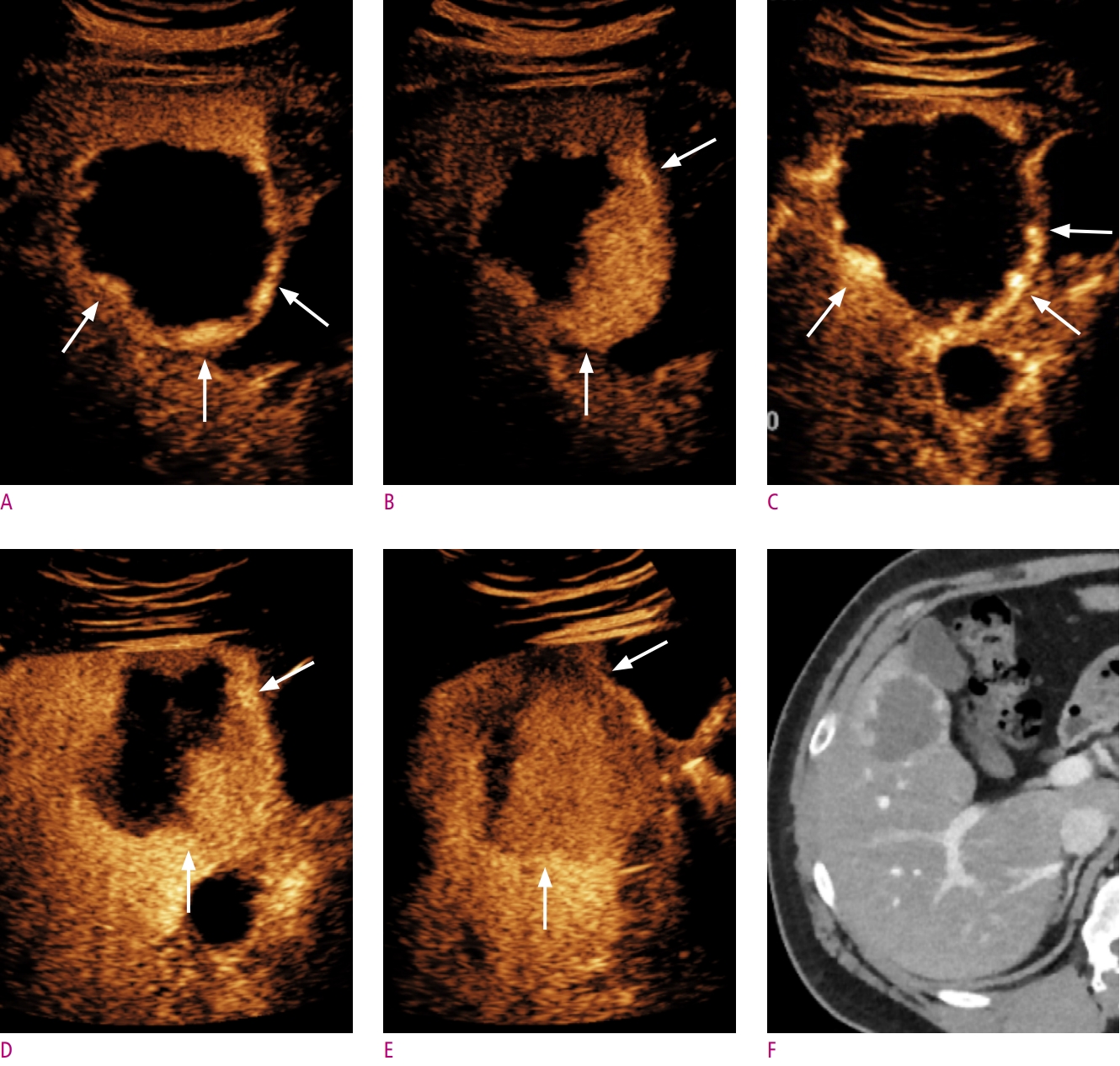
초창기 조영증강초음파 연구들에서 간경화 환자에서 발생한 간내담도암의 50%가 동맥기 조영증강 및 씻김을 보여 간세포암으로 오진될 가능성이 높음을 보고한 바 있고, 이는 과거 간세포암 진단에 조영증강초음파가 활발히 사용되지 않은 이유 중 하나이다[11, 12]. 그러나 이후 연구에서 대부분의 간내담도암은 간세포암과 달리 동맥기에서 가장자리 주변으로 동맥기 조영증강이 보이거나 (rim APHE), 씻김이 조기에 일어나거나 (조영제 주입 후 60초 이전), 타공한 것 같은 (punched-out) 높은 강도의 씻김 (marked washout)이 보이는 것이 밝혀졌고, 이를 LR-M category (malignancy other than HCC)로 분류하면서, 동맥기 조영증강 패턴 및 씻김의 시간과 강도를 반영한 현재의 간세포암 진단기준이 자리잡게 되었다[13-15] (Fig. 2). 아울러 가장 흔한 고혈관성 병변 중 하나인 hemangioma의 경우 CT, MRI 소견과 유사하게 동맥기에서 peripheral globular enhancement pattern 및 구심성 조영증강을 보일 경우 혈관종으로 간주할 수 있고 (Fig. 3), 조영증강초음파 LI-RADS에서는 위 소견을 보일 경우 LR-1 (definitely benign)로 분류한다.
Terzi 등[16]의 연구에 따르면 1006개의 고위험 결절에 대해 조영증강초음파 LI-RADS를 적용하였을 경우, LR-5 (definitely HCC)는 98.5%의 양성예측도 (positive predictive value)를 보였다. 간내담도암이 LR-5 category로 분류된 경우는 없었다. 대신 LR-M (probably or definitely malignancy but not HCC specific)의 경우 44%가 간세포암, 56%가 간세포암 이외의 악성종양이었다. 이 진단기준은 간세포암 진단에 특이도가 높은 것이 특징이며[17], European Association for the Study of the Liver (EASL) 및 Korean Liver Cancer Association (KLCA)-National Cancer Center (NCC) 가이드라인에서도 동일 진단기준을 사용한다[18, 19]. 다만 이 진단 기준은 순수혈관조영제 기준이다.
(2) Kupffer제를 이용한 간세포암 진단
소나조이드 조영증강 초음파의 간세포암 동맥기 영상소견은 소노뷰와 유사하다. 43개의 간세포암을 대상으로 두 조영제의 혈관기 영상소견을 비교한 연구에서, 동맥기 조영증강 패턴은 100% 일치하였다. 그러나 씻김이 처음 확인되는 시간과 씻김 정도에는 두 조영제 간 차이를 보였다[17]. 이는 동맥기 이후부터 Kupffer 세포의 소나조이드 포식이 영상에 영향을 미칠 가능성을 의미하기도 한다.
간세포암을 포함한 일부 종양에서 Kupffer 세포의 수의 감소로 Kupffer기에서 낮은 echogenicity를 보인다 (Figs. 1-3). 이러한 특징으로 소나조이드 조영증강 초음파 검사가 간세포암 발견에 높은 민감도를 보이는 것으로 보고된 바 있다[20, 21]. Japan Society of Hepatology 가이드라인에 따르면[22], MRI에서 동맥기 조영증강을 보이지 않은 결절의 2차 진단 검사로서 소나조이드를 사용할 때 동맥기 조영증강 혹은 Kupffer기의 낮은 echogenicity를 보이면 간세포암으로 진달할 수 있다. 그러나 Kang 등[17]의 간세포암 고위험군 환자를 대상으로 한 연구에서 10개의 간세포암 이외의 악성종양 중 3개의 병변에서 동맥기 조영증강 및 Kupffer기의 낮은 echogenicity를 보였다. 또한 Sugimoto 등[23]의 연구에 따르면, 73.9% (36/46)의 혈관종에서 Kupffer기의 낮은 echogenicity를 보였다. 가도제틱산 (Gadoxetic acid, Primovist, Bayer)를 이용한 간 MRI 검사에서, 간담도기 (hepatobiliary phase)에서 간세포암 이외의 국소 결절도 낮은 signal intensity를 보이는 원리와 같다[24]. 이는 Kupffer기의 낮은 echogenicity가 간세포암에 특이적인 소견이 아님을 반증한다. 한편 Hwang 등[21]의 최근 연구에 따르면, Kupffer기의 낮은 echogenicity를 씻김의 대안으로 가정하였을 경우, 그렇지 않은 경우와 비교하여 특이도(63.6% vs. 69.7%, P = 0.5)에 통계적으로 유의미한 변화 없이 민감도(83.2% vs. 74.2%, P = 0.008)의 상승을 보이는 것으로 보고하였다. Inoue 등[25]의 연구에서는 이형성결절과 초기 간세포암을 감별할 때, 두 병변 모두 Kupffer기에서 낮은 echogenicity를 보이는 경우가 흔하지 않지만, Kupffer기에서 낮은 echogenicity를 보이면 초기 간세포암으로 진단할 수 있음을 보고한 바 있다.
소나조이드를 이용한 조영증강 초음파 검사의 또 다른 고려점은, Kupffer세포의 조영제 포식으로 인한 가성씻김효과 (pseudowashout effect)와 이로 인한 위양성 (false-positive)이다[24]. 가도제틱산을 이용한 간 MRI 검사에서, 이행기 (transition phase)에 보이는 낮은 signal intensity를 씻김으로 인정하지 않는 이유와 같다. Kupffer 세포의 소나조이드 포식이 어느 시점부터 영상에 유의미한 영향을 미치는지에 대한 기준은 아직 더 많은 연구와 논의가 필요하다. 최근 Kang 등[26]의 연구에 따르면, 소나조이드 주입 후 씻김을 평가하는 시기를 1분에서 10분까지 1분 간격으로 나누어 간세포암 진단능을 비교하였을 때, 조영제 주입 후 6분까지 씻김을 평가하였을 때 특이도의 유의미한 변화 없이 민감도의 상승을 보고한 바 있다.
(3) 초음파 조영제에 따른 진단능 비교
소노뷰와 소나조이드 조영증강 초음파의 간세포암 진단능을 비교하였을 때, Kang 등[17]의 대상자내 (intraindivisual) 연구에 따르면, 고위험 군에서 소나조이드를 이용한 간세포암 진단시 소노뷰와 같은 진단기준 - 동맥기 조영증강 (≥ 1 cm) 및 60초 이후에서 보이는 경도의 씻김 (mild washout) - 을 적용하였을 경우, 특이도의 유의한 차이 없이 소나조이드가 더 높은 민감도를 보였다 (Figs. 1-3). 해당 논문에서, 간세포암의 동맥기 조영증강 패턴에는 유의미한 차이는 없었으나 소나조이드를 이용하였을 경우 소노뷰의 경우보다 평균적으로 씻김이 조금 더 늦게 관찰되며 (중위값, 101 ± 11초 vs. 84 ± 5초) 이로 인해 조기 씻김 (early washout) 현상이 소노뷰보다 낮은 빈도로 관찰되는 것이 진단능의 차이를 보이는 이유로 기술한 바 있다. Lv 등[27]의 연구에서는 B-mode 초음파 검사에 조영증강초음파를 추가로 수행하였을 경우에 보이는 정확도 차이를 두 조영제 간 비교하였고, 3명의 판독자가 각각 평가하였을 시, 소나조이드를 사용하였을 경우 각각 17%, 20%, 16%의 정확도 향상을 보여 19%, 16%, 20%의 정확도 향상을 보였던 소노뷰와 비교시 비열등함을 보여주었다 (비열등성 한계: - 20%).
(4) CT 및 MRI와 진단능 비교
전술한 바와 같이 CT, MRI 조영제와 초음파 조영제는 생체학적 특징이 다를 뿐 아니라, 검사를 수행하는 기술적 측면에서도 차이가 있다. 조영증강초음파는 초음파 창의 제한이 있으므로, 미리 정해진 대상 병변에 대해서만 평가가 가능하고, CT 및 MRI에 비해서 병변의 위치나 환자 요소, 검사자의 숙련도에 의한 영향을 많이 받아 제한적인 검사가 되는 경우가 더 빈번하다. 실제 여러 연구에서 조영증강초음파 검사의 간세포암 진단 민감도는 40-65%로 CT (65-75%)나 MRI (70.6%-90%) 검사에 비해 낮다[24, 28-30]. 그러나 조영증강초음파는 특이도가 높은 검사로 (91.5-100%) [29, 30], 간질로의 조영제 이동이 없어 동문맥단락 같은 혈관가성병변이 없으며, 혈역학적 정보를 연속적으로 확인 가능한 것이 장점이다.
(5) 2차 영상 검사로써의 조영증강초음파의 역할
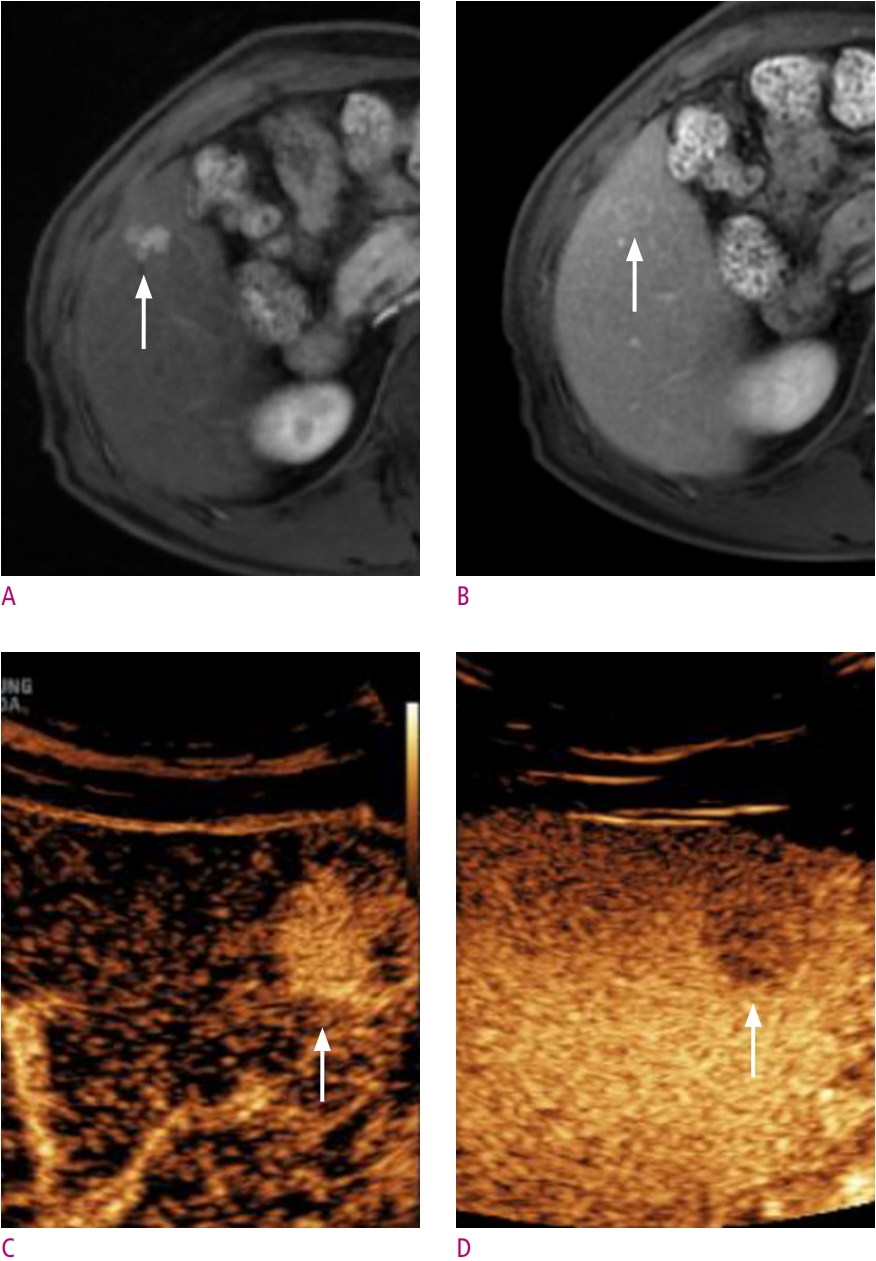
EASL 및 KLCA-NCC 가이드라인에 따르면, 조영증강초음파는 CT 혹은 MRI 검사에서 대상 병변이 간세포암의 영상 진단기준을 만족하지 못할 경우, 2차 검사로써 조영증강초음파를 고려해 볼 수 있다[18, 19, 29, 31]. 조영증강초음파는 혈역학적 정보를 실시간으로 평가할 수 있어 CT 혹은 MRI 검사에서 실제 동맥기 및 문맥기와 영상획득 시각의 차이로 발생하는 오류를 최소화 할 수 있다. 최근 한 연구에서는 CT, MRI 검사에서 동맥기 조영증강을 보이지 않는 국소 간병변에 조영증강초음파를 시행하였을 경우 43개 중 12개의 병변 (27.9%)에서 새롭게 동맥기 조영증강이 확인된 것을 보고한 바 있다[32]. Aube 등[30]의 연구에 따르자면, EASL 가이드라인을 적용하였을 경우, 10-20 mm 크기의 병변에서 MRI 검사 혹은 CT 검사 단독 보다, 조영증강초음파를 2차 검사로 사용하였을 경우, 유의한 민감도 (61.1% vs. 83.4%) 및 특이도 (55.6% vs. 76.8%)의 상승을 보였다 (Figs. 4 and 5). MRI 검사 후 2차 검사로 CT와 조영증강초음파를 비교하였을 때 민감도(44.2% vs. 34.6%, P = 0.36)에 유의한 차이를 보이지 않았고 CT검사보다 높은 특이도 (74.5% vs. 90.2%, P = 0.01)를 보였다. Kang 등[29]의 연구에서도, 위 가이드라인에 따라 소노뷰를 이용한 조영증강초음파를 2차 검사로 시행하였을 경우, 간 MRI 단독 검사보다 가이드라인의 HCC 민감도 (EASL, 72.2% vs. 83.5%; KLCA-NCC 86.1% vs. 91.1%)가 특이도의 변화 없이 유의하게 상승한 것을 보고하였다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print