소나조이드 조영제 초음파검사를 사용한 간세포암의 진단 가이드라인: 2023 대한영상의학회–대한복부영상의학회 권고문
Diagnosing Hepatocellular Carcinoma Using Sonazoid Contrast-Enhanced Ultrasonography: 2023 Guidelines from the Korean Society of Radiology and the Korean Society of Abdominal Radiology
Article information
Abstract
소나조이드는 2세대 초음파 조영제로 최근 간결절 진단에 활용되기 위한 목적으로 도입되었다. 대한영상의학회와 대한복부영상의학회는 공동으로 소나조이드 조영증강 초음파 검사를 통한 간세포암 진단 가이드라인을 마련했으며, 근거 검색을 통해 새롭게 개발한 권고문에 대해 전자 투표로 개발자 간 합의를 통하여 권고문을 선택하였다. 본 가이드 라인은 올바른 검사를 위한 검사 프로토콜을 비롯하여, 간세포암 진단기준, 다른 영상검사 결과에서 결론 내리기 힘든 병변에 대한 진단적 가치, 간세포암종을 제외한 악성종양과의 감별, 위험군에서의 간세포암의 감시검사로서의 역할, 간세포암종에 대한 국소 및 전신 치료 후 치료 반응 평가를 위한 소나조이드 검사에 관한 권고문을 다루고 있다.
Trans Abstract
Sonazoid, a second-generation ultrasound contrast agent, was introduced for the diagnosis of hepatic nodules. To clarify the issues with Sonazoid contrast-enhanced ultrasonography for the diagnosis of hepatocellular carcinoma (HCC), the Korean Society of Radiology and Korean Society of Abdominal Radiology collaborated on the guidelines. The guidelines are de novo, evidence-based, and selected using an electronic voting system for consensus. These include imaging protocols, diagnostic criteria for HCC, diagnostic value for lesions that are inconclusive on other imaging results, differentiation from non-HCC malignancies, surveillance of HCC, and treatment response after locoregional and systemic treatment for HCC.
서 론
소나조이드 (SonazoidⓇ, perfluorobutane, GE Healthcare)는 중국, 일본, 한국, 노르웨이, 싱가포르 및 대만에서 임상 사용이 승인된 2세대 초음파 조영제이며, 승인된 적응증은 성인 환자의 국소 간질환의 감별진단을 위한 조영증강 초음파(CEUS)검사에서의 사용이다[1].
소나조이드는 순수 혈액풀 조영제인 다른 2세대 조영제와는 달리 복합 혈액풀 및 쿠퍼세포 제제이며, 아시아초음 파의학회 (Asian Federation of Societies for Ultrasound in Medicine and Biology; AFSUMB)는 전문가 의견을 기반으로 한 소나조이드의 임상적 사용에 대한 합의문과 권고안을 2020년에 발표한 바 있다[2]. 이 기존 지침은 소나조이드의 특성과 흔한 국소 간 병변의 전형적인 영상 소견을 다루고 있으나, 간세포암에 대한 소나조이드 조영증강 초음파의 진단 기준 및 진단능을 다루지 않았으며 간 영상 보고 및 데이터 시스템 (Liver Imaging Report And Data System; LI-RADS) 적용 가능 여부가 불분명하다. 최근의 메타 분석 연구[3]에서 소나조이드 사용 시 각각 90%의 민감도와 97%의 특이도를 보고했지만, 분석에 포함된 연구들이 동일한 진단기준을 사용하지 않아 간세포암의 진단 성능이 진단 기준에 의해 좌우될 수 있는 여지가 있다.
다시 말하면, 소나조이드 조영증강 초음파의 간세포암 진단 기준에 관한 두 가지 해결되지 않은 문제점이 있는데, 첫번째 문제는 간세포암의 주요 영상소견인 특징적인 동맥기 과조영증강 (arterial phase hyperenhancement; APHE)과 씻김 (washout)을 소나조이드 조영증강 초음파에 적용할 수 있는가 하는 것이고, 두번째 질문은 간세포암 진단에서 쿠퍼기 영상의 역할에 관한 것이다. 대부분의 소나조이드 미세기포는 간의 굴모양혈관 (sinusoid)에서 쿠퍼 세포에 의해 흡수되기 때문에 지연기에서 다른 조영제를 사용한 조영증강 초음파 검사보다 배경 간실질의 조영 증강이 더 두드러져 보이는 점을 고려해야 한다. 따라서 소나조이드에 대한 신뢰성 있는 연구를 위해서는 용어의 표준화 및 조영증강 초음파 진단 지침을 마련해야 한다.
2021년에는 대한영상의학회(KSR)와 대한복부영상의학회(KSAR)의 지원을 받아 조영증강 초음파검사를 전문으로 하는 국내 복부영상의학과 전문의 20명이 8가지 핵심 질문을 바탕으로 소나조이드 조영증강 초음파로 간세포암을 진단하기 위한 가이드라인을 개발하였다. 가이드라인 개발 기간으로 약 1년(2021년 5월 ~ 2022년 5월)이 소요되었으며, KSAR 연차총회에서 가이드라인이 발표되었다. 대한간암학회 및 대한초음파의학회 등 관련 학회에도 공유 및 지지승인이 요청되었고 검토를 통하여 승인되었다. 이 가이드라인의 목표는 소나조이드 조영증강 초음파를 사용하여 간세포암 진단을 위한 근거 기반 표준을 제공하는 것이다.
Guideline Development Methodology
Literature search
현재까지 출간된 소나조이드에 관한 임상 연구가 많지 않으므로, 검색되는 관련 논문을 모두 가이드라인 개발을 위한 근거자료 후보로 수집하였고 핵심 질문 각각과 관련된 논문을 개별 개발그룹에서 선택하여 분석하는 방식으로 진행하였다.
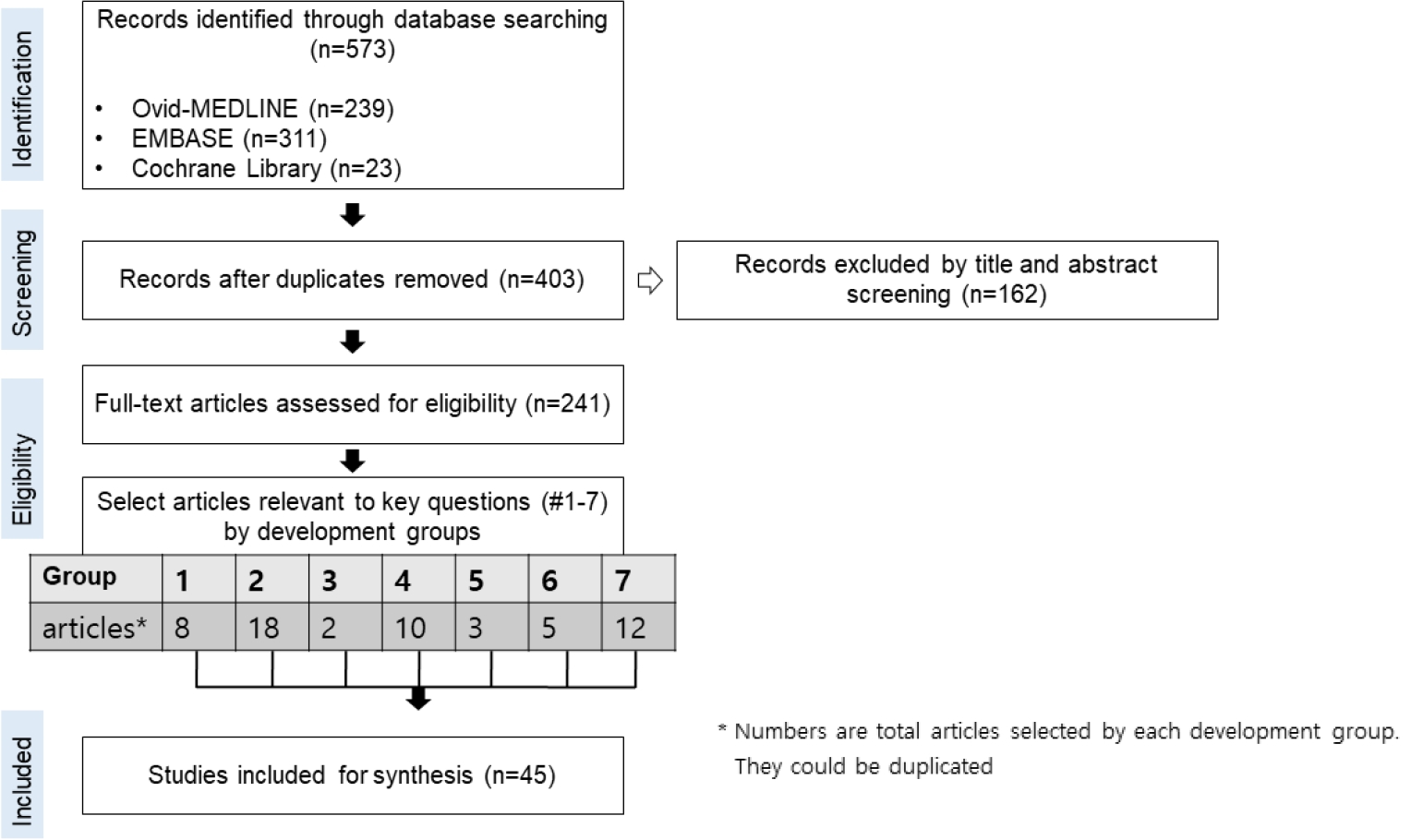
개발에 참여한 영상의학과 전문의와 문헌 검색의 경험이 많은 연구 사서가 MEDLINE, EMBASE 및 COCHRANE 라이브러리에 수록된 영어 출간 자료의 체계적인 문헌 검색을 수행하였고, 검색 키워드는 ‘HCC’, ‘ultrasound’, ‘Sonazoid’ (또는 ‘Kupffer phase’)였다. 검색 일자는 2021년 10월 15일이었다. 제외 기준은 1) 영어로 작성되지 않은 것, 2) 원저 또는 체계적 문헌고찰 및 메타 분석이 아닌 것, 3) 논문의 전체 텍스트를 얻을 수 없는 것, 4) 인간 대상 연구가 아닌 것이었다. 데이터베이스에서 573개의 연구가 검색되었고 중복 제거 후에 403개의 문헌으로 간추렸다. 적격성에 대한 1차 심사 후 선택된 241개의 논문을 추가로 분석하였다 (그림 1).
Developing key questions
연구자들은 총 7개의 개발그룹으로 나뉘어 핵심 질문을 개발하였다. 제1그룹은 소나조이드 조영증강 초음파의 진단 기준에 밀접하게 관련된 두 가지 핵심 질문에 대한 권고를 만들었고, 나머지 그룹들은 각각 하나씩의 핵심 질문과 권고를 작성하였다. 각 팀은 1차 선택을 마친 문헌 전체(n=241)에서 핵심 질문 관련 연구를 각각 찾고 근거표에 포함되어야 할 연구를 선택하였다 (2차 선택, 보충 표 1-7). 2차 선택 과정을 통해 각 개발 그룹에서 총 45개의 연구를 가이드라인 개발을 위한 최종 근거자료로 선정하였다. 선택한 모든 연구의 질평가는 QUADAS-II (Quality Assessment of Diagnostic Accuracy Studies-II) (보충 표 1-7, 보충 그림 1)를 사용하여 가이드라인 개발 경험이 있는 영상의학과 전문의가 수행하였다.
Recommendation statements
권고 수준은 선택된 근거문헌의 고찰을 기반으로 각각의 개발그룹에서 제시하였고, 근거 수준은 Oxford Center for Evidence-based Medicine [4](표 1)을 기반으로 하였다.
Consensus
개발 그룹에 참여한 모든 연구자들 간 합의를 위해 원격회의 방식(Zoom, Zoom Video Communications)으로 두 번의 합의 회의(2022년 4월 21일 및 2022년 5월 11일)를 개최하였고, 웹 투표 시스템(네이버 오피스)을 사용한 무기명 투표로 의견을 수집하였다. 모든 권고문은 델파이 방식을 사용하여 연구자 모두가 논의하고 승인하였다. 이를 위해, 1) ‘매우 동의하지 않음’; 2) ‘주요 유보사항이 있어 대체적으로 내용에 동의하지 않음’; 3) ‘약간의 유보사항이 있어 대체적으로 내용에 동의하지 않음’; 4) ‘주요 유보사항이 있으나 대체적으로 동의함’; 5) ‘약간의 유보사항이 있으나 대체적으로 동의함’; 6) ‘매우 동의함’의 6가지 동의 등급을 사용하였으며, 참가자의 80% 이상이 ‘약간의 유보사항이 있으나 대체로 동의’하거나 ‘매우 동의’ (5 또는 6)로 문항을 채점하면 합의로 간주되어 권고문을 채택하였다.
Presentation and external evaluation
본 연구자들 간 합의된 권고안은 2022년 5월 21일 KSAR 연례 컨퍼런스에서 처음 발표되었고, 가이드라인 초안은 2023년 1월에 완성되었다. 또한 완성된 가이드라인 인쇄본은 대한간암학회와 대한초음파의학회의 지지 승인(endorsement) 심사를 거쳐 최종 승인되었다.
Sonazoid CEUS Examination Protocol
먼저 간세포암 진단을 위한 소나조이드 조영증강 초음파 검사 프로토콜을 제안하기 위해 본 가이드라인 개발과정에서 선택된 연구의 검사 프로토콜을 검토하였다 (보충 표 8). 조영제 주입 방법은 대부분의 연구에서 증류수와 소나조이드 분말의 현탁액을 주사 직전에 제조하여 체중 1 kg 당 0.015 mL를 주입하였고, 볼루스 주사 후 생리 식염수를 주입하였다. 초음파 영상 획득을 위해 0.2에서 0.3사이의 낮은 기계 지수 (mechanical index; MI)의 초음파를 사용하였다.
각 연구에서 혈관기와 쿠퍼기 영상 획득 시점을 조사하였는데, 혈관기는 주사 직후 시작되는 간 혈관의 조영증강 상태에서 획득한 영상으로 주입 후 1분 이상까지 획득하였는지를 살펴보았고, 쿠퍼 세포의 미세기포 탐식이 일어나는 지연기 영상인 쿠퍼기는 주입 후 10분 이내에 얻었는지 혹은 그 이후에 얻었는지를 살펴보았다. 또한 쿠퍼기 씻김을 보이는 병변의 동맥기 과조영증강만을 확인 하기 위해 쿠퍼기에서의 조영제 재주입 (Kupffer phase reinjection)을 사용하였는지를 보았다. 살펴본 45개 연구 중 36개 연구(80%)에서 혈관기 영상을 얻었고, 이 중 21개 연구는 1분 동안의 혈관기 영상을 분석하였다. 다른 2세대 조영제를 사용하는 대부분의 연구와 마찬가지로[5], 소나조이드로 혈관 영상을 얻기 위한 검사 프로토콜은 다음과 같았다. 동맥기는 미세기포가 간동맥에 나타날 때 시작되었으며 (조영제의 간동맥 도착, 주사 후 약 10초), 20~35초 동안 지속되었고, 문맥기는 동맥기가 끝나는 즉시 (주사 후 30-45초) 시작되었며 일반적으로 주사 후 2분간 지속되었다. 쿠퍼기에 관해 살펴보면, 32개 연구(71%)가 주사 후 10분에 쿠퍼기 영상을 얻었고, 7개(16%)는 주사 후 10분 미만에 얻었거나 시기를 지정하지 않았다. 6건의 연구가 쿠퍼기 씻김 병변에 대한 조영제 재주입을 수행하였다. 쿠퍼기를 포함하는 모든 연구에서 혈관기와 쿠퍼기 사이의 중간 시기를 구체적으로 따로 정의하지 않았다. 하지만, Shunichi 등에 따르면[6], 간 실질은 혈관 조영 시작부터 점진적으로 조영되며, 시간–강도 곡선에서 실질 조영 곡선은 약 1분에 간문맥의 조영 곡선과 교차하므로 문맥기는 60초 후에 끝나는 것으로 간주하고 1분에서 10분까지 이어지는 기간을 혈관–쿠퍼 이행기로 정의하자는 의견이 있었다.
위의 연구들을 종합적으로 검토하여, 본 가이드라인은 동맥기 (미세기포가 간동맥에 처음 도착할 때 시작하여 미세기포가 간 실질을 채울 때 종료), 1분 지연 (초기 문맥기, 조영제 주입 후 ≤1분) 및 2분 지연(후기 문맥기, 조영제 주입 후 ≤2분)을 포함한 기존의 혈관기와 주사 후 10분 이상 지연 후 획득하는 쿠퍼기, 그리고 혈관기와 쿠퍼기 사이의 중간시기인 혈관–쿠퍼 이행기(전환기; 조영제 주입 후 2분에서 10분사이)로 구성된 소나조이드 조영증강 초음파 검사 프로토콜을 제안하고자 한다 (그림 2). 위에서 언급한 바와 같이 혈관–쿠퍼 이행기에서는 순수 혈액풀 제제의 지연 단계와 달리 간실질의 조영증강이 더욱 두드러지며, 강 등의 연구에 따르면[7], 60초를 임계치로 하는 늦은 씻김과 6분을 임계치로 하는 쿠퍼기 조합이 간세포암의 진단에 최상의 성능을 보여주었다. 향후 혈관–쿠퍼 이행기의 임상적 중요성은 더 연구할 가치가 있는 것으로 보인다.
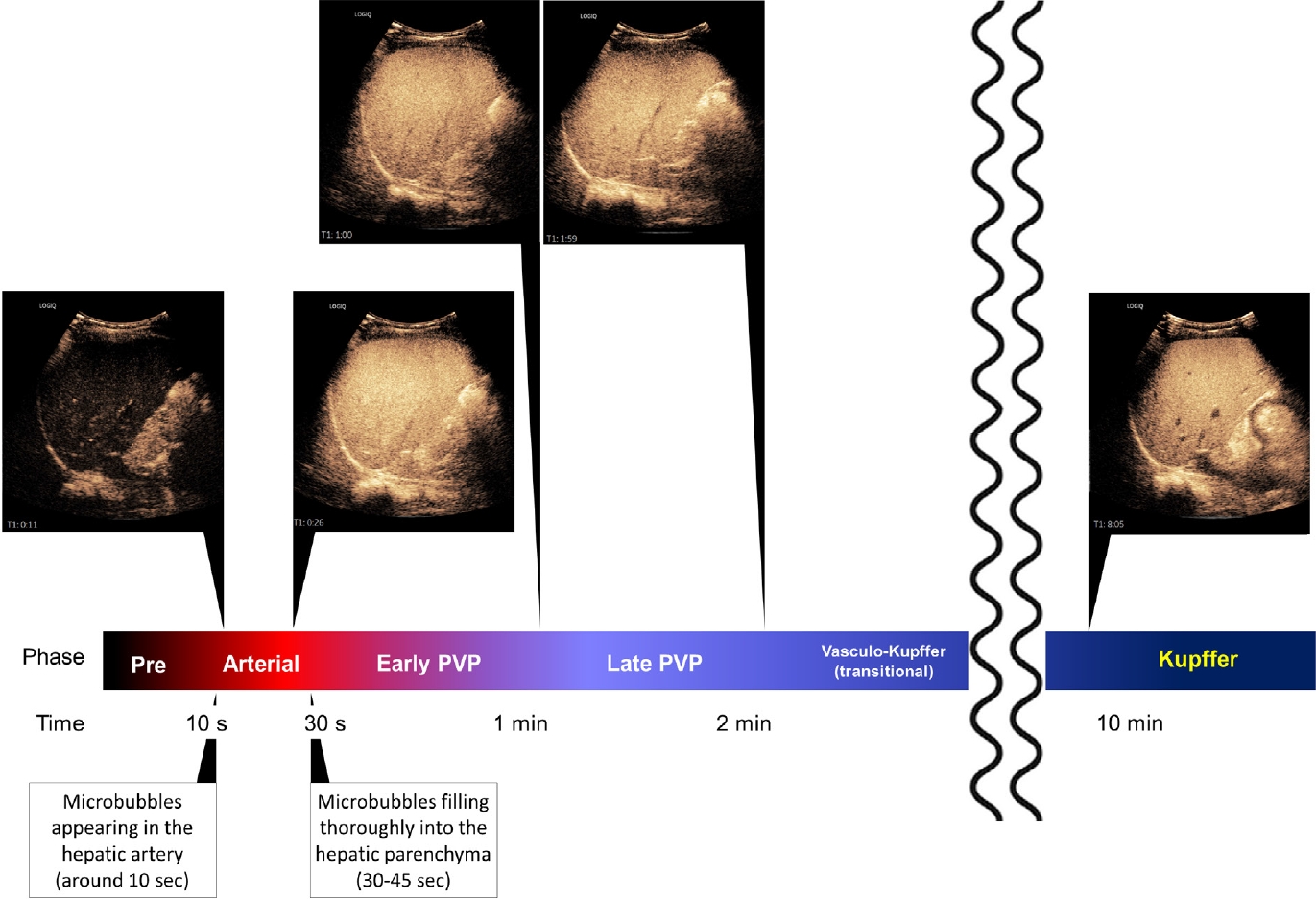
Suggested imaging protocol for perfluorobutane contrast-enhanced ultrasound. Given the evidence, the following examination protocol is suggested: arterial phase (from the time when microbubbles appear in the hepatic artery to the start of the portal venous phase [PVP] [30-45 s]); PVP, divided into two sub-phases of early portal venous phase (from the time when the liver parenchyma is completely filled with microbubbles [30-45 s] until 1 min later) and the late portal venous phase (from 1 to 2 min after injection); the vasculo-Kupffer (transitional) phase (from 2 to 10 min after injection); and the Kupffer phase (≥10 min after injection). Analysis of video clips is important for evaluating the perfusion of hepatic lesions. These guidelines recommend recording a video clip (or frequent imaging capture) of the vascular phase from the start of the arterial phase to the end of the early portal venous phase. Note: PVP=portal venous phase.
Questions and Recommendations
권고 요약은 표 2에 정리되어 있다.
질문 1. 소나조이드 조영증강 초음파에서 간세포암의 주요 특징은 무엇인가?
질문 1-1. 소나조이드 CEUS에서 간세포암종의 주요 영상 특징이 띠모양이 아닌 동맥기 과조영증강 (띠모양 및 주변부 결절형 혹은 구형이 아닌 동맥기 과조영증강) 와 늦은(≥60초) 및 경미한 씻김에 적합한가?
권고: 소나조이드 조영증강 초음파에서 띠모양이 아닌 동맥기 과조영증강과 늦은(≥60초) 및 경미한 씻김은 간세포암의 주요 영상 특징으로 적합하다. (권고등급: 강한 권고, 근거수준 II)
간암 발생 동안 간 결절 내 문맥과 짝을 이루지 않은 동맥(unpaired artery)의 밀도는 점진적으로 증가하며[8], CT/MRI에서 주변부 띠모양 조영증강이 아닌, 동맥기에서의 간실질보다 높은 조영증강(띠모양이 아닌 동맥기 과조영증강)은 고위험군 환자에서 간세포암을 진단하는 주요 영상의학적 특징으로 알려져 있다[9-12]. 마찬가지로 소나조이드 조영증강 초음파의 동맥기 과조영증강 역시 간세포암 위험군에서의 간세포암을 진단하는 데 중요한 영상 소견이다. 단, 전제 조건으로 띠모양 동맥기 과조영증강은 간내 담관암을 포함하는 악성종양, 바퀴살, 원심성 동맥기 과조영증강은 국소성 결절성 과증식증, 주변부 비연속성 결절형 동맥기 과조영증강은, 혈관종을 더 시사하는 소견이기 때문에 이와 같은 형태의 동맥기 과조영증강은 소나조이드 조영증강 초음파에서 간세포암의 주요 소견으로 간주되어서는 안 되며, 미만성인 동맥기 과조영증강을 띠모양이 아닌 동맥기 과조영증강이라고 하고 이를 간세포암의 주요소견으로 간주할 수 있다. 간세포암 의심 환자에서 CT/MRI LI-RADS와 소나조이드 조영증강 초음파를 비교한 이전 연구에 따르면[13], CT/MRI LR-5의 89.6%와 LR-4 환자의 85.9%가 소나조이드 조영증강 초음파에서 띠모양이 아닌 동맥기 과조영증강을 보인 반면, LR-3(악성과 양성의 중간 확률) 환자에서는 57.6%만 보였었다. 113개의 간세포암 의심 결절에 대한 소나조이드 조영증강 초음파 연구에서[7] 띠모양이 아닌 동맥기 과조영증강은 비간세포암(56.2% [9/16])이나 양성 병변(20% [3/15])보다 간세포암(86.8% [72/82])에서 더 빈번하게 보였다. 59개의 간세포암 의심 결절에 대한 연구에서도 일관된 결과를 보였는데[14], 띠모양이 아닌 동맥기 과조영증강은 간세포암의 95% (41/43), 비간세포암종의 30% (3/10), 양성 병변의 16.7% (1/6)에서 관찰되었다. 또한 순수 혈액 풀 조영증강 초음파검사와 소나조이드 조영증강 초음파의 개인 내 비교에서 간세포암의 동맥기 조영 패턴은 동일하였고, 아마도 소나조이드 조영증강 초음파의 동맥 단계에서는 쿠퍼 세포 섭취로 인한 영향을 무시할 수 있는 거의 순수한 혈관 영상이기 때문일 것으로 생각된다[1]). 간암 발생 동안의 또 다른 주요 변화는 문맥 구조물의 감소이다[8]. 이로 인해 동맥기에서 문맥기, 지연기로 진행할수록 간조직에 비해 간결절 내부 조영증강의 시간적 감소로 정의되는 씻김 현상이 나타난다[10]. 따라서 CT/MRI에서 씻김은 위험군에서 간세포암을 진단하기 위한 주요 영상 특징 중 하나로 여겨진다[9-12]. 하지만 CT/MRI와 달리 조영증강 초음파의 초기 연구에서는 씻김 현상의 특징이 간세포암과 간내 담관암을 구별하기에 충분하지 않다고 보고되었고[15], 이로 인하여 조영증강 초음파로의 간세포암 진단을 신뢰하기 어렵다는 의견이 있었다. 그러나 후속 연구를 통해 순수 혈액풀 제제를 이용한 조영증강 초음파 검사에서 늦은(≥60초) 씻김 시기와 약한 씻김 (조영증강이 남아 있으나, 간 실질보다는 덜 조영증강된 결절) 이 간세포암과 다른 악성종양을 감별하는데 중요한 특징으로 인정되고 있다[16-20]. 반면 소나조이드의 고유한 특성–쿠퍼 세포에 탐식되는–은 주변 간실질의 상대적으로 과도한 조영증강으로 인한 가짜 씻김효과를 유발할 수 있으므로 씻김 현상을 평가하는 데 보다 주의 깊은 접근이 필요하다. 소나조이드 주사 후 50초부터 씻김 시기를 관찰한 연구에서, 씻김 현상 시작이 가장 많이 관찰되는 시기는 72초-120초였지만 간세포암의 21%(15/73)가 60초 전에 씻김 현상의 시작을 보였고, 소나조이드 조영증강 초음파에서 늦은 씻김을 60초 이후로 정의하면 특이도와 양성예측도(PPV)는 100%였다[7]. 따라서 소나조이드 조영증강 초음파에서 띠모양이 아닌 동맥기 과조영증강과 늦은, 약한 씻김 현상이 간세포암의 위험이 있는 환자의 진단에 적합한 주요 영상 소견이며 4건의 연구에서 뒷받침된다[7, 13, 14, 21].
질문 1-2. 쿠퍼기 씻김을 소나조이드 조영증강 초음파에서 간세포암 진단의 주요 영상 소견으로 사용할 수 있는가?
권고: 띠모양이 아닌 동맥기 과조영증강 병변이 혈관기동안 이른 씻김 또는 현저한 씻김을 나타내지 않는 경우 위험군에서의 간세포암 진단을 위한 소나조이드 조영증강 초음파의 또다른 주요 영상 특징으로 고려할 수 있다. (권고등급: 조건부 권고, 근거수준 II)
쿠퍼기 씻김은 쿠퍼기에 간실질보다 낮은 조영증강 영역으로 정의되며 병변 내 감소된 쿠퍼 세포 수를 반영한다. 쿠퍼기 씻김을 소나조이드 조영증강 초음파의 주요 영상 소견으로 고려하면 간세포암 고위험군에서 간세포암 진단의 민감도가 향상된다는 이점이 있다. 이전 소나조이드 조영증강 초음파 연구에 따르면 띠모양이 아닌 동맥기 과조영증강이 있는 조직병리학적으로 입증된 간세포암의 7.8%-13.0%에서는 혈관기에 씻김을 보이지 않고 쿠퍼기 씻김만 보였다[22-26]. 따라서 쿠퍼기 씻김은 늦은 (≥60초), 약한 씻김에 비해 추가적으로 더 많은 간세포암을 진단할 수 있다. 쿠퍼기에서만 씻김이 있는 띠모양이 아닌 동맥기 과조영증강은 명백한 간세포암이나(0/48) 중등도(3/42 [7.1%]) 및 미분화 간세포암(0/6)보다 초기 간세포암 (4/16 [25%]), 결절 내 결절형 간세포암 (5/5 [100%]), 분화가 잘 된 간세포암(3/16, [18.8%])에서 더 흔하였다[22, 23]. 고위험군 환자에 대한 또 다른 전향적 연구에서, 쿠퍼기 씻김은 늦고 약한 씻김보다 (93% 대 77%-79%) 간세포암에서 더 흔한 소나조이드 조영증강 초음파 소견이었으며[14], 이른 씻김이 없는 띠모양이 아닌 동맥기 과조영 증강과 쿠퍼기 씻김으로 정의되는 수정된 LR-5 기준을 위험군 환자에게 적용했을 때 간세포암 진단의 양성예측도가 93.8%로 높게 보고되었다[27].
하지만, 쿠퍼기 씻김은 간세포암에 특이적이지 않기 때문에 특이도가 감소할 위험이 있다. 따라서 쿠퍼기 씻김을 평가할 때 혈관기 동안 이른 씻김 또는 현저한 씻김(조영제 주입 후 2분까지 사실상 조영증강이 없는 "타공[punch-out]” 소견)의 배제와 같은 예외가 필요하다[28]. 조직병리학적으로 입증된 악성 병변을 연구한 이전 소나조이드 조영증강 초음파 연구 결과에 따르면 모든 전이 (9/9), 간내 담관암의 91.3% (21/23), 혼합 간세포-담관상피암종의 80% (4/5)에서 띠모양 동맥기 과조영증강, 이른 씻김 혹는 현저한 씻김이 나타났다[14, 24, 27]. 그럼에도 불구하고, LI-RADS 기준 (띠모양이 아닌 동맥기 과조영증강 및 늦고 약한 씻김)과 쿠퍼기 씻김 기준(띠모양이 아닌 동맥기 과조영증강과 쿠퍼기 씻김)을 비교한 소나조이드 조영증강 초음파의 진단 성능에 대한 연구에서 쿠퍼기 씻김 기준은 특이도의 손실 없이 간세포암 진단에 더 높은 민감도와 정확도를 보였다 [24]. 따라서 띠모양 동맥기 과조영증강이나 혈관기 동안 이른 씻김 또는 현저한 씻김이 없다면, 고위험군을 대상으로 한 소나조이드 조영증강 초음파 검사에서 쿠퍼기 씻김이 간세포암 진단을 위한 주요 영상 소견으로 간주될 수 있다.
질문 2. 고위험 환자에서 소나조이드 조영증강 초음파를 사용하여 간세포암종을 진단하는 적절한 기준은 무엇인가?
권고: 늦고 약한 씻김 또는 쿠퍼기 씻김을 동반한 띠모양이 아닌 동맥기 과조영증강이 있는 고위험 환자에서 발견된 1 cm 이상의 결절은 간세포암으로 진단할 수 있다. (권고 등급: 조건부 권고, 근거수준 II)
19건의 연구에서 간세포암 진단을 위한 소나조이드 조영증강 초음파의 성능을 보고했지만[13, 14, 27, 29-44], 68%(13/19)가 후향적[13, 27, 29-32, 34-37, 39, 40, 42], 그리고 간세포암에 대한 자세한 진단 기준을 명확하게 기술하지 않았다는 한계점이 있다. 대부분의 연구에서는 소나조이드 조영증강 초음파의 간세포암 진단 기준으로 띠모양이 아닌 동맥기 과조영증강과 함께 쿠퍼기 씻김과 혈관기 동안의 늦은 씻김/약한 씻김을 병용, 또는 병용하지 않고 각각 사용하였다. 그러나 씻김의 정도 또는 시기에 대한 정의가 명시적으로 제시되지 않았으며 일부 연구에서는 늦은 씻김 및 약한 씻김과 쿠퍼기 씻김을 결합하는 방법에 대해 모호하게 기술되어 있다. 따라서 조영증강 초음파 LIRADS와 같은 정확하고 미리 정의된 기준과 용어를 향후 연구에 적용하는 것이 바람직하다. 소나조이드와 순수 혈액풀 조영증강 초음파를 개별적으로 비교하는 전향적 연구에서 1 cm 이상의 결절에서 늦고, 약한 씻김이 있는 띠모양이 아닌 동맥기 과조영증강이 있으면 간세포암이라는 조영증강 초음파 LI-RADS 진단 기준을 채택하였다. 소나조이드 조영증강 초음파는 순수 혈액풀 조영증강 초음파보다 유의하게 높은 민감도와 (79% 대 54%) 동일한 특이도를 (100%) 보였다[14]. 따라서 이를 근거로 간세포암종에 대한 조영증강 초음파 LI-RADS 진단 기준을 소나조이드 조영증강 초음파에 적용할 수 있다고 결론을 내릴 수 있다.
간세포암에 대한 조영증강 초음파 LI-RADS 진단 기준이 원래 순수 혈액풀 제제에 대해 개발되었다는 점을 감안할 때, 이 기준을 소나조이드 조영증강 초음파에 적용하기 위해 일부 수정이 필요할 수 있는데, 최근의 후향적 연구에서 쿠퍼기 씻김을 사용하는 수정된 조영증강 초음파 LIRADS 진단 기준은 특이도 손실 없이 (70% 대 64%) 기존의 약한 씻김 및 늦은 씻김을 능가하는 우수한 민감도 (83% 대 74%)를 보였다[13]. 또 다른 후향적 연구에서는 조영증강 초음파 LI-RADS 진단 기준을 동일하게 수정하여 70%의 민감도와 93%의 특이도를 보고하였다[27]. 이러한 연구는 소나조이드 조영증강 초음파에서 쿠퍼기 씻김을 포함하는 수정된 조영증강 초음파 LI-RADS 기준이 유효함을 시사한다. 따라서 본 가이드라인에서는 고위험 환자에서 관찰된 늦은 씻김 및 약한 씻김 또는 쿠퍼기 씻김을 동반한 띠모양이 아닌 동맥기 과조영증강을 보이는 1 cm 이상의 결절을 간세포암으로 진단할 수 있음을 제안한다. 또한 비 간세포암 악성종양에서 쿠퍼기 씻김을 보일 수 있기 때문에, 특이도를 유지하기 위해 간세포암 진단에서의 쿠퍼기 씻김은 이른 씻김(<60초) 또는 혈관기 동안 현저한 씻김을 보이지 않는 경우에만 제한적으로 적용할 수 있다[45]. 또한 조영증강 초음파 LI-RADS 기준과 마찬가지로 동맥기 과조영증강은 간내 담관암의 일반적인 영상 소견인 띠모양 동맥기 과조영증강, 혈관종의 전형적 소견인 주변부 단속성 구형 조영증강이 있는 병변에 적용해서는 안 된다[45]. 여러 단면 연구에서[13, 27] 적절한 연구 설계로 수정된 조영증강 초음파 LI-RADS 진단 기준의 성능을 보고한 점을 감안할 때 이러한 진단 기준을 조건부로 권고할 수 있다.
질문 3. 소나조이드 조영증강 초음파는 HCC 고위험 환자의 CT 또는 MRI에서 발견된 불확실한 결절을 감별 진단하는 데 사용할 수 있는가?
권고: 소나조이드 조영증강 초음파는 결절의 동맥기 과조영증강을 실시간으로 감지하고 결절 내에서 쿠퍼 세포 활성도를 보여줄 수 있기 때문에 CT 또는 MRI에서 진단이 불확실한 결절을 감별하는 데 사용할 수 있다. (권고등급: 조건부 권고, 근거수준 III)
간 전체를 평가할 수 있는 단면 영상 방식의 조영 증강 CT 또는 MRI와 달리 소나조이드 조영증강 초음파는 일반적으로 간의 특정 국소 병변을 검사하기 위해 이용된다. 따라서 아시아태평양간학회 가이드라인과 대한간암학회–국립암센터 진료지침에서는 CT와 MRI로 진단되지 않은 결절에 대한 2차 영상의학적 방법으로 소나조이드 조영증강 초음파를 권고하고 있다[46, 47]. 조영 증강 CT 또는 MRI에 비해 소나조이드 조영증강 초음파의 장점은 뛰어난 시간 해상도이다. 한 번 또는 여러 번의 시점에서 동맥기 영상을 얻을 수 있기 때문에 병변을 포함하는 간을 초기 혈관기부터 실시간으로 모니터링할 수 있다. 따라서 이론적으로 소나조이드 조영증강 초음파는 제한된 시간 창이나 부적절한 영상 획득 타이밍으로 인해 조영 증강 CT 또는 MRI에서 놓친 동맥기 과조영증강을 감지할 수 있는 잠재력이 있다. 이전 연구에 따르면 소나조이드 조영증강 초음파는 조영증강 CT에서 과조영증강을 보이지 않는 병변의 29.4%와 MRI에서 과조영증강을 보이지 않는 병변의 43.2%에서 동맥기 과조영증강을 발견하였다[48, 49].
조영증강 CT 또는 MRI에 비해 소나조이드 조영증강 초음파가 갖는 또 다른 이점은 쿠퍼기 영상획득이다. 또한, 환자 안전에 관한 면에서도 소나조이드 조영증강 초음파는 방사선 피폭의 위험이 없으며 다른 조영제 검사에 비해 안전하다고 간주된다[50]. 따라서 소나조이드 조영증강 초음파는 뛰어난 시간 해상도와 쿠퍼기 영상을 통해 조영 증강 CT 또는 MRI에서 진단을 확정하지 못한 결절의 정확한 진단을 내리는 데 사용할 수 있다.
질문 4. 소나조이드 조영증강 초음파는 간세포암과 비간세포암 악성종양을 감별할 수 있는가?
권고: 소나조이드 조영증강 초음파는 간내 담관암 및 간전이암과 같은 비 간세포암 악성종양으로부터 간세포암을 감별할 수 있다. (권고수준: 조건부 권고, 근거수준 III)
간내 담관암은 간세포암 다음으로 흔한 원발성 간암으로 간세포암 위험이 있는 환자의 검진 과정에서 가끔 발견된다[51]. 따라서 특히 간경변증이 있는 경우 간내 담관암과 간세포암의 정확한 감별이 매우 중요하다. 회색조 초음파에서 간내 담관암은 그 크기에 따라 에코가 다른 종괴로 나타나며 대개 불규칙한 변연, 저에코 띠모양, 주변 담관 확장을 동반한다[52].
순수 혈액풀 조영증강 초음파 검사에서 간내 담관암의 전형적인 특징은 띠모양 동맥기 과조영증강, 이른 씻김 및 현저한 씻김이며[17, 32, 53-55] 조영증강 초음파 LIRADS에서 LR-M으로 분류한다[28]. 조영제 주입 10분 후 쿠퍼기 씻김으로 표시되는 소나조이드 조영증강 초음파에서만 보일 수 있는 소견은 비 간세포암 악성종양의 진단에 대해 높은 양성 예측도를 보였다[27]. 하지만 간세포암 위험이 있는 환자에서 소나조이드 조영증강 초음파의 띠모양 동맥기 과조영증강에 대해 수행한 최근 연구에서는 특이도가 100% (56/56)이지만 간내 담도암과 간세포암을 구별하는 민감도가 떨어진다고 보고하였다 (16.7%, 1/6) [27]. 유사하게 강 등은[14] 비 간세포암 악성종양 진단을 위한 띠모양 동맥기 과조영증강의 민감도 범위는 40% ~ 50% 이지만 특이도는 100% (43/43)로 보고하였다. 이른 또는 현저한 씻김은 소나조이드 조영증강 초음파에서 간내 담도암과 간세포암을 구별하는데 띠모양 동맥기 과조영증강보다 더 유용하였으며, 간세포암 발생의 위험이 있는 환자들 사이에서 높은 민감도(100% [6/6])와 특이도(90.6% [58/64])를 보였다[27]. 이 씻김 패턴은 간내 담도암의 낮은 종양 내 혈액량과 넓은 세포 외 간질 공간으로 인해 나타나는 것으로[15, 56, 57], 특히 주변 정상 조직 내 쿠퍼 세포의 조영제 탐식으로 인해 소나조이드 조영증강 초음파에서 씻김 정도가 더 두드러진다. 이러한 소견은 간내 담도암의 CT/MRI 소견에서 보이는 전반적이고 씻김이 없는 점진적 조영증강과는 다른데, 미세기포와 달리 CT/MRI에 사용되는 조영제는 혈관 내피를 통과해 누출되어 종양 조직의 간질에 축적될 수 있어 CT/MRI에서는 씻김을 보이지 않는다[56, 58-60]. 또한 미분화 간세포암 및 미세혈관 침범이 있는 간세포암에서도 조영증강 초음파에서 이른 씻김을 보일 수 있다[61, 62]. 한편, 현저한 쿠퍼기 씻김의 진단적 가치에 대해 상충되는 결과를 보고한 연구가 있는데, 한 연구에서는 모든 간내 담도암이 현저한 쿠퍼기 씻김을 보인데 반해 (6/6) 간세포암종의 25.0% (16/64)만이 뚜렷한 쿠퍼기 씻김을 보였다고 보고하였고[27], 또 다른 연구에서는 쿠퍼기 씻김의 정도와 빈도가 간내 담도암 및 간세포암 간에 차이가 없다고 보고하였다[14]. 따라서 쿠퍼기에서의 현저한 씻김이 간내 담관암과 간세포암을 구별하는 역할을 할 수 있는지 밝히기 위해서는 추가 연구가 필요하다. 간 전이암은 흔한 간의 악성종양임에도 불구하고 주로 간경변이 없는 간에서 발생하므로 간내 담도암의 진단보다 덜 중요하다. 그렇지만 소나조이드 조영증강 초음파소견은 잘 알려져 있으며 띠모양 동맥기 과조영증강, 문맥기 및 혈관–쿠퍼 이행기 동안의 낮은 조영증강, 쿠퍼기의 명확한 저에코성 결손이 특징이다[5, 31, 32, 63-65].
전반적으로 소나조이드 조영증강 초음파는 국소 간 병변들의 감별진단에 높은 민감도와 특이도로 충분한 진단 성능을 보인다[32, 36, 37, 44, 65]. 그러나 띠모양 동맥기 과조영증강 및 이른 씻김을 포함하여 중복되는 영상 특징을 고려할 때 간세포암, 간내 담도암 및 간전이암 사이에서 명확한 조영증강 초음파 기반 감별진단은 제한적일 수 있다.
질문 5. 소나조이드 조영증강 초음파를 고위험 환자의 간세포암 감시 도구로 사용할 수 있는가?
권고: 소나조이드 조영증강 초음파는 고위험 환자의 감시 도구로 사용될 수 있다. (권고등급: 조건부 권고, 근거수준 III)
간세포암의 고위험 환자에 대한 감시를 위해 회색조 초음파가 기본 영상검사 방법으로 널리 사용된다. 그러나 간 형태의 심한 변화나 음창이 매우 좋지 않은 환자에서 작은 간세포암을 발견하기에는 정확도가 낮아 상당히 비효율적이다[66]. 소나조이드 조영증강 초음파는 간 전체를 검사할 수 있도록 긴 시간 범위를 갖는 쿠퍼기를 제공함으로써 주로 쿠퍼기 씻김으로 나타나는 간세포암을 발견하는데 도움을 주어 회색조 초음파의 한계를 극복할 수 있다. 따라서 소나조이드 조영증강 초음파는 간암 위험이 있는 환자, 특히 거친 간에코를 가진 환자에서 작은 간세포암을 감지하는 데 특히 민감도를 높일 것으로 예상된다.
Kudo 등의 초기 연구에서 밝힌 바로는, 소나조이드 조영증강 초음파는 292명의 간경변증 환자에서 회색조 초음파에서 발견되지 않은 27개의 쿠퍼기 씻김 병변을 발견할 수 있었고 27개 병변에 대해 조영제 재주입을 실시하여 16개 병변에서 종양의 과혈관성을 확인하였으며, 조직학적으로 모두 간세포암(크기 범위: 6~13 mm)임을 확인하였다[67]. 또 다른 연구에서는 262명의 간경변 환자를 대상으로 소나조이드 조영증강 초음파 검사의 쿠퍼기 영상에서 7개의 간세포암을 포함한 9개의 추가 결절을 발견하였다[68]. 다기관 무작위 통제 시험에서 간세포암 발생 위험도가 매우 높은 일본인 환자를 대상으로 쿠퍼기를 이용한 간세포암 감시와 회색조 초음파를 이용한 기존 방법의 간세포암 감시를 비교한 결과 최초 발견 시 간세포암의 평균 크기가 회색조 초음파 그룹보다 쿠퍼기 그룹에서 훨씬 더 작았다 (13.0 mm 대 16.7 mm; P = 0.011) [69]. 흥미롭게도 하위 그룹 분석에서 C형 간염 환자에서는 이러한 차이가 발견되었지만 B형 간염 환자에서는 그렇지 않았다. B형 간염이 우세한 한국인 환자를 대상으로 한 최근의 또 다른 전향적, 다기관, 개인 내 비교 연구(SCAN 연구)에서는 간세포암 감시 중 회색조 초음파에 소나조이드 조영증강 초음파를 추가하면 초기 간세포암의 발견률이 약간 증가하였고 (0.8% vs. 1.1%, P = 0.160), 위양성율(false referral rate)을 유의하게 감소시켰다 (4.4% vs. 1.1%, P <0.001) [70]. 아직 프로토콜이 확립되어 있지는 않지만, 소나조이드 조영증강 초음파를 간세포암 감시에 사용하는 경우, 특히 대규모 센터에서 검사 시간을 최소화하기 위해 혈관기 영상 없이 쿠퍼기 영상만 사용하는 것이 적절할 수 있고, 쿠퍼기 씻김이 있는 병변이 발견되면 소나조이드를 추가로 투여하여 결절의 과조영증강을 평가할 수 있다[2]. 반면 CT나 MRI 검사 활용이 어렵거나 신장 기능 장애가 있는 환자, 또는 CT나 MRI 조영제에 과민반응의 병력이 있는 환자의 경우에도 소나조이드 조영증강 초음파 검사를 통한 감시 검사를 고려할 수 있다.
비용 효과 검토는 제안한 검사방법이 감시 도구로 사용될 수 있는지 여부를 결정하는 중요한 단계이며 문헌 검색 결과 단 하나의 일본 연구 만이 소나조이드 조영증강 초음파의 이러한 측면을 고려하였다[71]. 무감시 그룹과 비교하여 회색조 초음파 및 소나조이드 조영증강 초음파 감시 그룹은 각각 $17,296 미국달러(USD)/품질 조정 수명 (QALY) 및 $18,384 USD/QALY의 증분 비용 효율성 비율(ICER)을 나타내었고, 일반적으로 비용 효과가 허용되는 기준인 $50,000 USD/QALY 미만이었다. 또한 소나조이드 조영증강 초음파 그룹을 회색조 초음파 그룹과 비교했을 때에는 ICER이 $24,250 USD였으므로 이 때에도 소나조이드 조영증강 초음파가 비용 효과가 있다고 할 수 있다. 그러나 그 연구는 만성 C형 간염의 자연경과를 기반으로 한 의사 결정 모델과 일본에서 발표된 문헌만을 기반으로 한 비용 데이터를 사용했기 때문에 국내 사정에 일반화하여 적용하기는 어려운 단점이 있다.
질문 6. 소나조이드 조영증강 초음파는 간세포암의 국소치료법의 유도검사로써 도움이 되는가?
권고: 소나조이드 조영증강 초음파는 회색조 초음파에서 눈에 띄지 않는 작은 간세포암의 발견 가능성과 선명도를 증가시키기 때문에 국소치료를 유도하는 데 도움이 된다. (권고등급: 강한 권고, 근거수준 II)
일반적으로 간세포암의 국소치료법은 편리성과 실시간 성 때문에 초음파 유도 하에서 시행된다. 간세포 특이 조영제 및 확산 강조 영상과 같은 최신 MRI 기술은 매우 작은 간세포암을 진단할 수 있지만[72, 73] 이러한 작은 간세포암은 회색조 초음파에서 잘 보이지 않는 경향이 있기 때문에 초음파 유도 시 위치를 찾아 치료하는 것이 어려울 수 있다[74]. 소나조이드 조영증강 초음파의 쿠퍼기라는 고유한 특징은 표적 병변과 정상 간 실질 조직의 에코 발생 차이를 통해 간세포암의 민감도를 높인다는 장점이 있고[2], 또한 쿠퍼기는 소나조이드 정맥 주사 후 60-120분 동안 지속되며[24], 이러한 긴 시간범위는 작은 간세포암에 대한 국소치료를 가능하게 한다.
많은 연구에서 소나조이드 조영증강 초음파 유도 고주파 열치료술(RFA)이 회색조 초음파 유도검사에 비해 치료효과를 달성하는 데 필요한 국소치료의 세션 수를 줄이고 병변 발견이 우수하다는 강점을 입증하였다[39, 75-77]. 이전 연구에 따르면 소나조이드 조영증강 초음파는 회색조 초음파 단독보다 52명의 환자에서 69개의 결절을 더 발견하였다. 소나조이드 조영증강 초음파와 회색조 초음파를 이용한 간세포암의 발견율은 각각 93.2%와 83.5%였다 (P = 0.04) [39]. 이 등의 전향적 연구에 따르면[76], 쿠퍼기 영상은 회색조 초음파와 비교하여 31개의 간세포암(31/43, 72%)이 있는 29명의 환자에서 병변의 선명도와 시술자의 진단 신뢰도를 증가시켰다. 또한 소나조이드 조영증강 초음파 유도는 회색조 초음파 유도 단독으로 치료 시 필요한 치료 세션 횟수와 비교하여 세션 수를 줄일 수 있었고[39, 77], 지속적인 국소 종양 제어를 통해 회색조 초음파 유도보다 더 나은 치료 결과로 이어질 수 있었다[78]. Minami 등의 연구에 따르면[77], 지속적인 국소재발 억제율은 회색조 초음파 유도 그룹보다 조영증강 초음파 유도 RFA 그룹에서 더 높았다. (1년 국소재발 억제율 92.1% 대 76.3%; 2년 국소재발 억제율 85.3% 대 66.4%)
또한 CT나 MRI를 이용한 초음파 융합 영상은 간세포암에 대한 국소치료법 중 목표 종양을 찾기 위해 종종 사용된다. 소나조이드 조영증강 초음파를 사용한 융합 영상 역시 간세포암에 대한 국소치료법의 기술적 타당성과 병변 선명도를 개선하는 강력한 도구가 될 수 있다[79].
질문 7. 경동맥 화학색전술 (TACE) 또는 고주파열치료 (RFA)를 시행받은 환자에서 간세포암의 치료 반응을 평가하기 위해 소나조이드 조영증강 초음파를 사용하는 것이 적절한가?
권고: 조영증강 초음파에서 3개 미만의 지표 종양이 관찰되는 경우 소나조이드 조영증강 초음파는 TACE 또는 RFA 후 치료 반응을 평가하는 데 유용할 수 있다. (Recommendation level: conditionally recommended, Evidence level III)
일반적으로 간세포암종의 치료 반응을 평가하기 위해 조영증강 CT나 MRI를 이용하며 그 효과는 널리 검증되어 있다. 또한 상대적으로 제한적이긴 하지만, 국소 치료 후 간세포암의 반응을 평가하기 위해 소나조이드 조영증강 초음파의 유용성을 검정한 여러 연구가 있다[80-82]. 초음파 유도 RFA를 시행한 환자에서 추가 치료가 필요한지 확인하기 위해 소나조이드 조영증강 초음파를 이용하여 시술 3시간 후 간세포암의 생존 부위 여부를 평가하였고[81], 또 다른 연구에서는 소나조이드 조영증강 초음파가 간세포암의 RFA 후 5 mm 이상의 치료 변연 확보 여부의 평가에 있어서 조영증강 CT보다 더 민감 하였다고 보고하였다[80]. 또한 간세포암에 대한 RFA와 TACE 이후 소나조이드를 이용한 일련의 조영증강 초음파 검사가 동적 조영증강 CT보다 국소 재발 진단에 더 정확하고 관찰자의 경험에 덜 영향을 받았다는 보고가 있었다[83]. 또한 TACE 또는 경동맥 방사선색전술 후의 치료 목표 종양의 경우에도 소나조이드 조영증강 초음파는 간세포암의 생존부위 여부나 치료 반응을 평가하는 데 도움이 되었다[84-86]. 그러나 대부분의 연구에서 환자 수가 충분하지 않고 무작위 대조 시험이 없기 때문에 강력한 권고를 하기에는 임상적 근거가 부족하였다.
여러 연구들은 방사선 요법 및 전신 항암 요법 후 소나조이드 조영증강 초음파 및 관류 매개변수가 치료 반응을 예측하는 데 유용하다는 사실을 밝혔는데, Funaoka 등은 소나조이드 조영증강 초음파가 방사선 치료 후 간세포암을 평가하는 데 도움이 된다고 보고했고[87], 소라페닙과 같은 전신 항암 제제로 간세포암을 치료한 후 관류 매개변수를 검사하거나 조영증강 여부를 평가하기 위해 소나조이드 조영증강 초음파를 사용하는 것이 치료 반응을 예측하는 데 도움이 되었다고 하였다[88-91]. 그러나 국소적 치료와 마찬가지로 대부분의 연구는 50명 미만 적은 수의 환자를 연구대상으로 하였으며 평가 매개변수가 확립되지 않은 예비 연구 설계를 가지고 있었다. 또한 조영증강 초음파를 이용한 관류 매개변수나 조영증강 패턴 평가는 임상에 바로 적용하기가 복잡하여 방사선 치료나 전신 항암 치료 후 간세포암을 평가하는 일반적인 방법으로 소나조이드 조영증강 초음파를 추천하기는 어렵고, 소나조이드 조영증강 초음파는 적은 수의 지표 종양이 동시에 관찰될 수 있는 경우 간세포암의 반응을 평가하기 위한 보완 옵션이 될 수 있다.
결 론
국소 간 병변에 대한 소나조이드 사용을 승인 받은 국가 수가 증가함에 따라 발표되는 연구의 숫자가 증가하고 있으며, 소나조이드 조영증강 초음파를 사용한 간세포암의 진단 기준이 포함된 가이드라인의 필요성이 대두하고 있다. 이 가이드라인은 소나조이드 조영증강 초음파에 대한 최대한 많은 문헌을 수집한 후 해당 분야 전문가들의 심층적인 검토와 공정한 합의 과정을 거쳐 개발되었으며, 향후 의료진이 간세포암 위험 환자에게 소나조이드 조영증강 초음파를 시행하고 그 결과를 치료에 활용하고자 하는 임상적 결정에 도움이 될 것으로 기대한다.
Notes
Funding
Required funding was provided by KSR and KSAR. Both KSR and KSAR had no influence on the content of the guideline.
Conflict of Interest
Woo Kyoung Jeong received honorarium from GE Healthcare and Bayer; Hyo-Jin Kang received honorarium from GE Healthcare; Mi-Suk Park received grant from GE Healthcare and Guerbet; Bohyun Kim was a consultant for Samsung Medison; Min Woo Lee received honorarium from Bracco, Starmed, Bonston Scientific, and Medtronic, and was a consultant for Starmed and Medtronic; Jeong Ah Hwang received honorarium from GE Healthcare; Jae Young Lee received grant from Canon Healthcare, Siemens Healthcare, Alpinion Medical System, and GE Healthcare and received honorarium from Philips, Canon Healthcare, GE Healthcare, Alpinion Medical System, and Siemens Healthcare; Jung Hoon Kim received honorarium from GE Healthcare; Ijin Joo received honorarium from Samsung Medison; So Yeon Kim received grant from Bayer Healthcare and Canon Healthcare; Jeong Min Lee received grant from Bayer Healthcare, Canon Healthcare, Siemens Healthcare, GE Healthcare, CMS, Guerbet, Samsung Medison, Starmed, RF medical, Clarify, and Dongkuk Pharma and received honorarium from Samsung Medison, Philips, GE Healthcare, Bayer, Guerbet, and Clarify.
Acknowledgements
The authors would like to thank Dr. Mi Young Choi (National Evidence-based Healthcare Collaborating Agency), Chang Hee Cho (The Korean Society of Radiology) and Euisoo Shin (University of Ulsan College of Medicine, Asan Medical Library) for consulting on the evidence search and guideline development process.
This article is a republication of the original paper published in English in the Korean Journal of Radiology (Korean J Radiol 2023;24:482-497) translated into Korean with the original publisher's consent.
Supplementary Material
The Supplement is available with this article at https://doi.org/10.52668/kjar.2023.00038